题目内容
7.利用下列装置,可完成很多电化学实验.下列有关叙述,正确的是( )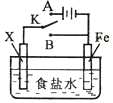
| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | |
| B. | 若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| C. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 | |
| D. | 若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 |
分析 开关K置于B处,为原电池装置,X比Fe活泼可减缓铁的腐蚀;开关K置于A处,为电解池装置,Fe为阴极可减缓铁的腐蚀,结合发生的电极反应来解答.
解答 解:A.X为锌棒,开关K置于A处,形成电解池,Fe为阴极,可减缓铁的腐蚀,这种方法称为外加电源的阴极保护法,故A错误;
B.若X为铜棒,开关K置于A处,为电解池反应,铁为阴极,阳极上铜被氧化生成铜离子,阳极上不生成氯气,故B错误;
C.若X为碳棒,开关K置于B处,为铁的吸氧腐蚀,正极发生还原反应,氧气得电子生成氢氧根离子,滴入酚酞溶液变红,故C正确;
D.若X为碳棒,开关K置于B处,为铁的吸氧腐蚀,铁被氧化生成亚铁离子,滴加滴入硫氰化钾溶液不变色,故D错误.
故选C.
点评 本题考查原电池和电解池的工作原理,准确把握K的位置及装置的判断为解答的关键,明确电极的判断及发生的电极反应即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
15.下列物质长期置于空气中质量不会增加的是( )
| A. | NaOH固体 | B. | 浓H2SO4 | C. | 碳酸钠晶体 | D. | Na2SO3溶液 |
15.在一定条件下,氯气可与氯化铵发生如下反应:xCl2+NH4Cl═yNClx+(x+y)HCl,当消耗6.72L标准状况下的Cl2时,生成0.100mol氮的氯化物,则此氮的氯化物的化学式为( )
| A. | NCl2 | B. | NCl3 | C. | NCl4 | D. | NCl5 |
12.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2、Na2CO3、盐酸、AgNO3 | B. | Na2CO3、盐酸、AgNO3、BaCl2 | ||
| C. | BaCl2、Na2CO3、AgNO3、盐酸 | D. | AgNO3、盐酸、BaCl2、Na2CO3 |
19.下列物质中能导电,但又不是电解质和非电解质的纯净物是( )
| A. | 熔融的NaCl | B. | 石墨晶体 | C. | 液氯 | D. | 盐酸 |
16.化学与科技、化学与生活息息相关.下列说法正确的是( )
| A. | 我国起征燃油税,这是政府推进节能减排的一项新举措.石油工业通过石油分馏得到汽油,主要发生了化学变化 | |
| B. | 2008年诺贝尔化学奖授予研究绿色荧光蛋白的科学家,利用丁达尔效应不能将蛋白质溶液和葡萄糖溶液区分开 | |
| C. | 广为人知的奶粉事件中的罪魁祸首为三聚氰胺(结构如 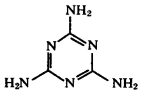 图),其摩尔质量为126g•mol-1 图),其摩尔质量为126g•mol-1 | |
| D. | 2010年4月支援青海玉树地震灾区的生活用品中的食醋、纯碱、食盐,其对应的主要化学物质分别属于酸、碱、盐 |
17.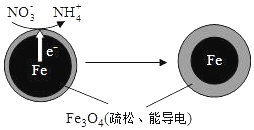 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
(1)Fe 还原水体中NO3- 的反应原理如图所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经 24 小时测 定NO3- 的去除率和 pH,结果如下:
pH 由 2.5 变为 4.5 时,NO3- 的去除率低,是因为生成了较多的不导电的FeO(OH),写出生成FeO(OH)的离子方程式:Fe3++2H2O?FeO(OH)+3H+.
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3- 的去除率.是因为 Fe2+能够破坏FeO(OH),氧化层生成Fe2O3.写出该反应的离子方式Fe2++2FeO(OH)=Fe3O4+2H+.
 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.(1)Fe 还原水体中NO3- 的反应原理如图所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经 24 小时测 定NO3- 的去除率和 pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 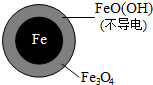 |  |
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3- 的去除率.是因为 Fe2+能够破坏FeO(OH),氧化层生成Fe2O3.写出该反应的离子方式Fe2++2FeO(OH)=Fe3O4+2H+.
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).