题目内容
2.某化学兴趣小组对某矿泉水进行检测,发现0.5L该矿泉水中含有10.8mg Mg2+,则Mg2+的物质的量浓度为9×10-4mol/L.分析 根据n=m/M计算出镁离子的物质的量,再根据c=n/V计算出镁离子的物质的量浓度.
解答 解:10.8mg Mg2+的物质的量为:n=$\frac{10.8×1{0}^{-3}g}{24g/mol}$=4.5×10-4mol,镁离子的物质的量浓度为:c(Mg2+)=$\frac{4.5×1{0}^{-4}mol}{0.5L}$mol=9×10-4mol/L,
故答案为:9×10-4mol/L.
点评 本题考查了物质的量浓度的计算的计算,题目难度中等,注意掌握物质的量与摩尔质量、溶液体积、物质的量浓度等物理量之间的转化关系,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
10.下列反应中,熵显著增加的反应是( )
| A. | CO(g)+2H2(g)═CH3OH(g) | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | C(s)+O2(g)═CO2(g) | D. | 2Hg(l)+O2(g)═2HgO(s) |
10.用NA表示阿伏德罗常数,下列叙述错误的是( )
| A. | 28g N2所含原子数为NA | B. | 0.5mol H2O所含原子数为1.5NA | ||
| C. | 1mol H2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
17.室温下,pH值为9的KOH溶液和pH值为9的Na2CO3溶液中,由水电离出的 c(OH-)大小为( )
| A. | 两者相等 | B. | 前者大 | C. | 后者大 | D. | 无法比较 |
7.利用下列装置,可完成很多电化学实验.下列有关叙述,正确的是( )
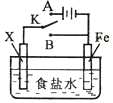

| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | |
| B. | 若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| C. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 | |
| D. | 若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 |
14.将O2、CH4、Na2O2置于密闭容器中,用电火花引燃,恰好完全反应,容器中无气体剩余,由此得出原混合物中O2、CH4、Na2O2的质量之比为( )
| A. | 1:2:6 | B. | 2:1:6 | C. | 8:8:117 | D. | 117:4:4 |
11.下列离子方程式中,正确的是( )
| A. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-=Cu(OH) 2↓+SO42- | |
| D. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO3- |