题目内容
15.下列物质长期置于空气中质量不会增加的是( )| A. | NaOH固体 | B. | 浓H2SO4 | C. | 碳酸钠晶体 | D. | Na2SO3溶液 |
分析 长期置于空气中质量中,易吸收水或与空气中的二氧化碳、氧气等反应,可导致质量增加,而碳酸钠晶体发生风化使质量减小,以此来解答.
解答 解:A.NaOH固体易潮解,吸收水,质量增加,故A不选;
B.浓硫酸具有吸水性,质量增加,故B不选;
C.碳酸钠晶体发生风化生成碳酸钠,使质量减小,故C选;
D.Na2SO3溶液与氧气反应生成Na2SO4,质量增加,故D不选;
故选C.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
5.用下列实验方案鉴别Na2CO3和NaHCO3两种白色固体,不能达到预期目的是( )
| A. | 加热,然后将气体生成物通入澄清石灰水,观察现象 | |
| B. | 向两种相同浓度的盐溶液中滴入稀盐酸,观察反应的剧烈程度 | |
| C. | 向两种相同浓度的盐溶液中滴入酚酞,观察颜色 | |
| D. | 向两种相同浓度的盐溶液中滴入氢氧化钡溶液,观察现象 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4.6g Na与足量氧气反应时转移电子的数目一定为0.2NA | |
| B. | 1mol Cl2参加反应时转移的电子数目为2NA | |
| C. | 1mol KClO3中含有的氯离子数目为NA | |
| D. | 22.4L O2中含有2NA个氧原子 |
10.下列反应中,熵显著增加的反应是( )
| A. | CO(g)+2H2(g)═CH3OH(g) | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | C(s)+O2(g)═CO2(g) | D. | 2Hg(l)+O2(g)═2HgO(s) |
10.用NA表示阿伏德罗常数,下列叙述错误的是( )
| A. | 28g N2所含原子数为NA | B. | 0.5mol H2O所含原子数为1.5NA | ||
| C. | 1mol H2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
7.利用下列装置,可完成很多电化学实验.下列有关叙述,正确的是( )
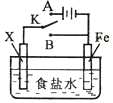

| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | |
| B. | 若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| C. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 | |
| D. | 若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 |
8.在甲、乙、丙三个容器中分别充入H2、N2、Cl2,若三个容器具有相同的温度和密度,则三个容器中的压强关系正确的是( )
| A. | p(甲)<p(乙)<p(丙) | B. | p(甲)>p(乙)>p(丙) | C. | p(甲)<p(丙)<p(乙) | D. | p(乙)>p(甲)>p(丙) |
 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线: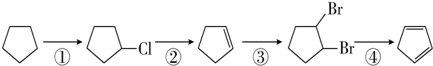
 ),途径如下:
),途径如下: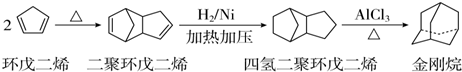
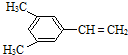 、
、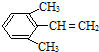 .
.