题目内容
2.对于铝热反应:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,下列说法中正确的是( )| A. | Fe元素的化合价升高 | |
| B. | 若27 g Al参加反应则有3 mol电子转移 | |
| C. | Fe2O3发生氧化反应 | |
| D. | Al被还原 |
分析 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3中,Al元素的化合价升高,Fe元素的化合价降低,以此来解答.
解答 解:A.Fe元素的化合价由+3价降低为0,故A错误;
B.若27 g Al参加反应则$\frac{27g}{27g/mol}$×(3-0)=3 mol电子转移,故B正确;
C.Fe元素的化合价降低,得到电子,则Fe2O3发生还原化反应,故C错误;
D.Al元素失去电子被氧化,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意基本概念的分析,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.关于下列分子的说法不正确的是( )
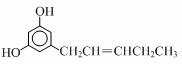
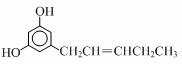
| A. | 既有σ键又有π键 | |
| B. | O-H键的极性比强于C-H键的极性 | |
| C. | 是非极性分子 | |
| D. | 该物质的分子之间不能形成氢键,但它可以与水分子形成氢键 |
13.二氧化碳和钠在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石).设NA为阿伏加德罗常数的值,下列有关此反应的叙述不正确的是( )
| A. | 金刚石是自然界最坚硬的单质 | |
| B. | 1 mol CO2中含有的共用电子对数目为2NA | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.1 NA |
10.具有相同电子层数的三种元素X、Y、Z,已知它们最高价氧化物对应水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4.下列判断正确的是( )
| A. | 三种元素的原子半径:X>Y>Z | B. | 三种元素的单质的氧化性:X>Y>Z | ||
| C. | 阴离子的还原性:X->Y2->Z3- | D. | 气态氢化物的稳定性:X<Y<Z |
7.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.24LCO或N2所含的电子数为1.4NA | |
| B. | 标准状况下,22.4升H2O中所含分子数小于NA | |
| C. | 常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA | |
| D. | 常温常压下,1.8 g H2O含有的质子数为NA |
11.工业制硫酸中,下列关于沸腾炉出来的气体主要成分描述中,最合理是( )
| A. | SO2、O2、N2 | B. | SO2、O2、N2、矿尘 | C. | SO2、SO3 | D. | Cl2、Ar、N2 |
12.下列叙述正确的是( )
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. |  、 、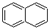 和 和 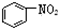 均属于芳香烃 均属于芳香烃 | |
| C. | 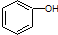 和 和 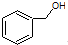 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
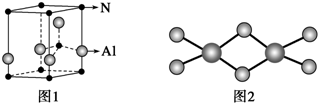
 .
.