题目内容
18.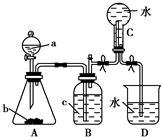 如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:
如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:(1)气体X的化学式是NO.
(2)所选药品a是稀硝酸,b是铜屑,装置B的作用是蒸馏水洗去NO2.
(3)在反应刚开始时A中的主要现象是铜屑溶解,溶液为浅蓝色,有气泡产生,瓶内上方出现红棕色气体.
(4)用所选的药品制取X的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
分析 (1)制取的气体不需要加热、难溶于水,根据提供的药品可知该气体为NO;
(2)用铜与稀硝酸反应制取一氧化氮气体,a为液体药品、b为固态药品,据此判断药品名称;装置B可以除去二氧化氮气体;
(3)根据铜离子的溶液为蓝色溶液、NO与空气中氧气反应生成红棕色的二氧化氮解答;
(4)写出铜与稀硝酸反应生成硝酸铜、一氧化氮和水的离子方程式.
解答 解:(1)在锥形瓶中制取X气体,且不需加热、收集X气体采用排水法(说明X不溶于水),结合给出的试剂可知,制取的气体只能为NO,故答案为:NO;
(2)a中盛放的为液体试剂,应该为稀硝酸;b为固体,应该为铜屑;装置B中盛放是蒸馏水,可以将NO中混有的二氧化氮除去,
故答案为:稀硝酸; 铜屑;蒸馏水洗去NO2;
(3)铜与稀硝酸反应生成硝酸铜、NO气体和水,金属铜溶解,溶液变为蓝色,有气泡产生,瓶内上方出现红棕色气体,
故答案为:铜屑溶解,溶液为浅蓝色,有气泡产生,瓶内上方出现红棕色气体;
(4)铜与稀硝酸反应制取NO气体的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查了铜与稀硝酸反应的实验,题目难度中等,注意掌握常见气体的性质及制备方法,明确化学实验基本操作方法,能够正确书写常见反应的离子方程式、化学方程式,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.要使工业废水中的Pb2+沉淀,依据如表数据可知,选用沉淀剂最好为( )
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
| A. | 碳酸盐 | B. | 硫酸盐 | C. | 硫化物 | D. | 以上沉淀剂均可 |
9.取两份质量相等的有机物M,一份与足量的钠反应放出气体V1升,另一份与足量NaHCO3溶液反应放出气体V2升;若同温同压下V1=V2,则M是( )
| A. | HCOOH | B. | HOOC-COOH | C. | HOCH2CH2COOH | D. |  |
6.化工生产中常用FeS做沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s)═CuS(s)+Fe2+(aq)
下列有关叙述中正确的是( )
下列有关叙述中正确的是( )
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| D. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 |
13.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A. | 从开始到平衡A的平均反应速率为0.3mol/(Ls) | |
| B. | 从开始到平衡B的转化率为60% | |
| C. | 此反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$ | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
3.下列说法正确的是( )
| A. | 按系统命名法,化合物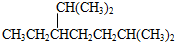 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使高锰酸钾溶液褪色 | |
| D. | 结构片段为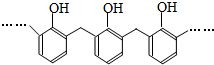 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
10.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
(1)表中元素,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是H2SO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HCl.
(4)A和D组成化合物的电子式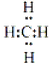 .
.
(5)用电子式表示B和H组成化合物的形成过程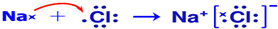
(6)B的最高价氧化物的水化物和C的最高价氧化物的水化物相互反应的离子方程式OH-+Al(OH)3═AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是H2SO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HCl.
(4)A和D组成化合物的电子式
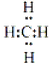 .
.(5)用电子式表示B和H组成化合物的形成过程
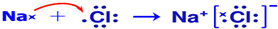
(6)B的最高价氧化物的水化物和C的最高价氧化物的水化物相互反应的离子方程式OH-+Al(OH)3═AlO2-+2H2O.
7.在一个5L的容器里,盛有8.0mol某气态反应物,5min后,测得这种气态反应物还剩余3.0mol,则这种反应物在此时间内的化学反应速率为( )
| A. | 0.1mol/(L•min) | B. | 0.2mol/(L•min) | C. | 0.3mol/(L•min) | D. | 0.4mol/(L•min) |
 苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )
苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )