题目内容
6.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2═C═O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P═O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P═O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
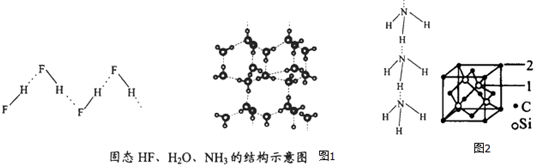
解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}}{4}$apm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3.
分析 (1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(3)根据碳原子的价层电子对数判断杂化轨道类型;单键均为σ键,双键中有1个σ键;
(4)氢键越多,沸点越高;
(5)根据均摊法计算晶胞中Si、C原子数目,每个Si原子周围有4个碳原子,原子配位数与原子数目成反比,可以计算碳原子周围与其距离最近的硅原子数目;
以顶点C原子研究,与之距离最近的C原子位于面心上,每个顶点原子为8个晶胞共用,每个面为2个晶胞共用;
作过1号Si原子的体对角线、2号碳原子的体对角线,相交于O点,与顶点碳原子形成如图所示: ,其中B为2号碳原子,C为1号Si原子,1号Si原子与周围的4个C原子形成正四面体,1号Si原子与顶点碳原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为$\sqrt{3}$a pm,则OA=OB=$\frac{\sqrt{3}}{2}$a pm,故OC=$\frac{\sqrt{3}}{4}$a pm,利用余弦定理计算cos∠AOB的值,再利用余弦定理计算BC的长度,即晶胞图2中1号硅原子和2号碳原子之间的距离;
,其中B为2号碳原子,C为1号Si原子,1号Si原子与周围的4个C原子形成正四面体,1号Si原子与顶点碳原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为$\sqrt{3}$a pm,则OA=OB=$\frac{\sqrt{3}}{2}$a pm,故OC=$\frac{\sqrt{3}}{4}$a pm,利用余弦定理计算cos∠AOB的值,再利用余弦定理计算BC的长度,即晶胞图2中1号硅原子和2号碳原子之间的距离;
结合晶胞中原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素,
故答案为:3;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2,
故答案为:3d84s2;
(3)在CH2=C=O中,一个碳原子的价层电子对数为$\frac{4+2}{2}$=3,另一个碳原子的价层电子对数为$\frac{4+0}{2}$=2,所以碳原子的杂化轨道类型有sp2和sp,1mol(C2H5O)3P═O分子中含有的σ键的数目为1mol×[(5+1+2)×3+1]×NA=25NA,
故答案为:sp2和sp;25NA;
(4)由数据可知,H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n,
故答案为:单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n;
(5)根据均摊法计算晶胞中Si、C原子数目,每个Si原子周围有4个碳原子,原子配位数与原子数目成反比,可以计算碳原子周围与其距离最近的硅原子数目;
以顶点C原子研究,与之距离最近的C原子位于面心上,每个顶点原子为8个晶胞共用,每个面为2个晶胞共用;
作过1号Si原子的体对角线、2号碳原子的体对角线,相交于O点,与顶点碳原子形成如图所示: ,其中B为2号碳原子,C为1号Si原子,1号Si原子与周围的4个C原子形成正四面体,1号Si原子与顶点碳原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为$\sqrt{3}$a pm,则OA=OB=$\frac{\sqrt{3}}{2}$a pm,故OC=$\frac{\sqrt{3}}{4}$a pm,则:
,其中B为2号碳原子,C为1号Si原子,1号Si原子与周围的4个C原子形成正四面体,1号Si原子与顶点碳原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为$\sqrt{3}$a pm,则OA=OB=$\frac{\sqrt{3}}{2}$a pm,故OC=$\frac{\sqrt{3}}{4}$a pm,则:
($\frac{\sqrt{3}}{2}$a)2+($\frac{\sqrt{3}}{2}$a)2-2×$\frac{\sqrt{3}}{2}$a×$\frac{\sqrt{3}}{2}$aa×cos∠AOB=a2,
解得cos∠AOB=$\frac{1}{3}$
故($\frac{\sqrt{3}}{4}$a)2+($\frac{\sqrt{3}}{2}$a)2-2×$\frac{\sqrt{3}}{4}$a×$\frac{\sqrt{3}}{2}$a×$\frac{1}{3}$=BC2,
解得BC=$\frac{\sqrt{11}}{4}$a;
晶胞质量为4×$\frac{28+12}{{N}_{A}}$g,则晶体密度为(4×$\frac{28+12}{{N}_{A}}$g)g÷(a×10-10 cm)3=$\frac{1.6×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:4;12;$\frac{\sqrt{11}}{4}$a;$\frac{1.6×1{0}^{32}}{{a}^{3}{N}_{A}}$.
点评 本题考查原子结构及晶胞计算等,为高频考点,把握电离能、杂化类型判断、氢键与物质的性质、晶体结构等为解答的关键,侧重分析与应用、计算能力的考查,综合性较强,题目难度较大.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | 微粒半径:Y>Z>X>W | |
| B. | 最高价氧化物的水化物的酸性:W<Z | |
| C. | 简单氢化物的稳定性:W>Z>X | |
| D. | X与W、Y形成的化合物中,其化学键类型相同 |
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 如图随着CO2的通入,$\frac{{c(OH}^{-})}{{c(NH}_{3}•{H}_{2}O)}$不断减小 | |
| C. |  在如图所示不同pH的溶液中一定存在关系:c(NH4+)≥2c(CO32-)+c(HCO3-)+c(NH2COO-) | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |
| 实验方案 | 实验现象 |
| ①将新制氯水滴加到NaBr溶液中,振荡后加入适量CCl4溶液,振荡,静置 | A.浮在水面上,熔成小球,四处游动,随后消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫色 |
| ③将溴水滴加到NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置 | C.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层红棕色 |
(1)实验目的:探究同主族元素性质的相似性和递变性.
(2)实验用品:①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol•L-1NaBr溶液、0.1mol•L-1NaI溶液、CCl4溶液等.
②仪器:试管、烧杯、胶头滴管、镊子、小刀、玻璃片等.
(3)实验内容(请把表中与实验方案对应的实验现象的标号和化学方程式补写完整):
| 实验方案 | 实验现象 | 化学方程式 |
| ① | D | Cl2+2NaBr═2NaCl+Br2 |
| ② | A | 2Na+2H2O═2NaOH+H2↑ |
| ③ | B | Br2+2NaI═2NaBr+I2 |
| ④ | C | 2K+2H2O═2KOH+H2↑ |
| 选项 | 实验操作现象 | 实验结论 |
| A | 向取了少量的KClO3晶体的试管中加入适量的蒸馏水,再向其中加入硝酸酸化的AgNO3溶液 | 该方法可以检验KClO3中是否含有氯元素 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色,将褪色溶液加热,品红颜色复原 | 该气体一定是SO2 |
| D | 向AgNO3溶液中加入足量的NaCl溶液,再加入KI溶液,再加入Na2S溶液,先后有白色沉淀变为黄色沉淀,最后又白色变为黑色沉淀 | Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S) |
| A. | A | B. | B | C. | C | D. | D |
 B.
B.  C.
C.  D.
D. 

 ;
;