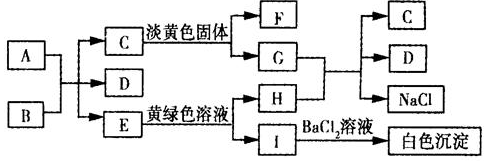
题目内容
2.一种熔融碳酸盐燃料电池原理示意图如图.下列有关该电池的说法不正确的是( )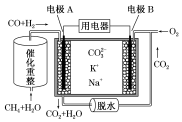
| A. | 反应CH4+H2O $\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1mol CH4转移6NA电子 | |
| B. | 电极A上H2参与的电极反应为H2+CO32--2e-=CO2+H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为O2+2CO2+4e-=2CO32- |
分析 A.根据C元素的化合价变化分析;
B.H2在负极上失电子生成水;
C.原电池中阴离子向负极移动;
D.电极B上氧气得电子发生还原反应.
解答 解:A.反应CH4+H2O $\frac{\underline{\;催化剂\;}}{△}$3H2+CO中,1molCH4→CO,化合价由-4价→+2,上升6价,则1molCH4参加反应共转移6mol电子,故A正确;
B.H2在负极上失电子生成水,则电极A上H2参与的电极反应为:H2+CO32--2e-=CO2+H2O,故B正确;
C.原电池中阴离子向负极移动,A通入燃料,则A为负极,所以CO32-向电极A移动,故C错误;
D.电极B上氧气得电子发生还原反应,则电极B上发生的电极反应为:O2+2CO2+4e-═2CO32-,故D正确.
故选C.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.用苯作原料,不能经一步化学反应制得的是( )
| A. | 硝基苯 | B. | 环己烷 | C. | 苯酚 | D. | 苯磺酸 |
13.在逻辑上概念之间存在如图所示关系.对下列概念之间关系的说法正确的是( )

| A. | 纯净物与混合物属于包含关系 | B. | 化合物与氧化物属于交叉关系 | ||
| C. | 单质与化合物属于并列关系 | D. | 氧化反应与化合反应属于并列关系 |
10.下列反应达到化学平衡后,加压或升温都能使化学平衡向逆反应方向移动的是( )
| A. | SO2(g)+NO2(g)?SO3(g)+NO(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | C(s)+CO2(g)?2CO(g)△H>0 | D. | H2S(g)?H2(g)+S(s)△H>0 |
17. 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是( )
 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是( )| A. | Mg2+、Al3+、Fe2+ | B. | Mg2+、Al3+ | C. | H+、Ba2+、Al3+ | D. | H+、Mg2+、Al3+ |
5.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0kJ/mol | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ/mol |
2.下列关于反应能量的说法正确的是( )
| A. | A、101kPa时,2H2(g)+O2(g)═2H2O(g)△H=-Q kJ•mol-1,则H2的燃烧热为$\frac{1}{2}$Q kJ•mol-1 | |
| B. | B、同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H相同 | |
| C. | C、500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热3kJ,其热化学方程式为N2(g)+3H2(g) $?_{催化剂}^{500℃,30MPa}$2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
3.下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A. | 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| B. | 以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- | |
| C. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |