题目内容
10.下列反应达到化学平衡后,加压或升温都能使化学平衡向逆反应方向移动的是( )| A. | SO2(g)+NO2(g)?SO3(g)+NO(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | C(s)+CO2(g)?2CO(g)△H>0 | D. | H2S(g)?H2(g)+S(s)△H>0 |
分析 根据化学平衡移动原理判断:增大压强,化学平衡向着气体体积减小的方向进行;升高温度,化学平衡向着吸热方向进行,以此解答该题.
解答 解:A.反应前后体积不变,增大压强平衡不移动,故A错误;
B.正反应为体积增大的反应,增大压强,平衡向逆反应移动,正反应为体积增大的反应,增大压强,平衡逆向移动,故B正确;
C.正反应是吸热反应,升高温度,平衡正向移动,故C错误;
D.正反应是吸热反应,升高温度,平衡正向移动,故D错误.
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握压强、温度对化学平衡的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
相关题目
1.25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO<HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
18.下列离子方程式正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
5.下列说法中,不正确的是( )
| A. | 光导纤维是以二氧化硅为主要原料制成的 | |
| B. | 二氧化硅溶于水生成硅酸 | |
| C. | 石英、水晶、玛瑙的主要成分都是二氧化硅 | |
| D. | 二氧化硅是一种熔沸点很高、硬度很大的氧化物 |
15.常温下,能溶于浓HNO3的单质是( )
| A. | Al | B. | Fe | C. | Cu | D. | Si |
2.一种熔融碳酸盐燃料电池原理示意图如图.下列有关该电池的说法不正确的是( )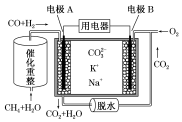

| A. | 反应CH4+H2O $\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1mol CH4转移6NA电子 | |
| B. | 电极A上H2参与的电极反应为H2+CO32--2e-=CO2+H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为O2+2CO2+4e-=2CO32- |
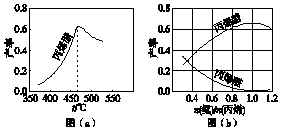 丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:
丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题: