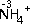题目内容
3.下列离子方程式或化学方程式与所述事实相符且正确的是( )| A. | 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| B. | 以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- | |
| C. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.0.1 mol/L、pH=1的NaHA溶液,可知为强酸的酸式盐,完全电离;
B.银为阳极,阳极上Ag失去电子,阴极氢离子得到电子;
C.酸性条件不能生成氢氧根离子;
D.使SO42-完全沉淀,以1:2反应,生成硫酸钡、氢氧化铝、一水合氨.
解答 解:A.0.1 mol/L、pH=1的NaHA溶液,可知为强酸的酸式盐,完全电离,则加入NaOH溶液的离子反应为H++OH-═H2O,故A正确;
B.银为阳极,阳极上Ag失去电子,阴极氢离子得到电子,则电解反应为2Ag+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+2AgOH↓,故B错误;
C.酸性条件不能生成氢氧根离子,则离子反应为IO3-+5I-+6H+═3I2+3H2O,故C错误;
D.使SO42-完全沉淀,以1:2反应,生成硫酸钡、氢氧化铝、一水合氨,离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意电解及与量有关的离子反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.一种熔融碳酸盐燃料电池原理示意图如图.下列有关该电池的说法不正确的是( )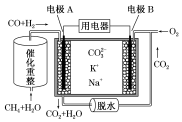

| A. | 反应CH4+H2O $\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1mol CH4转移6NA电子 | |
| B. | 电极A上H2参与的电极反应为H2+CO32--2e-=CO2+H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为O2+2CO2+4e-=2CO32- |
14.下列叙述正确的为( )
| A. | 阿伏伽德罗常数就是6.02×1023 | |
| B. | 1mol任何物质都约含有6.02×1023分子 | |
| C. | 3.01×1023 个Na+的物质的量是0.5 mol | |
| D. | 2molSO42-约含1.204×1024 SO42- |
18.有A2、B2两种单质,相互反应后生成化合物C.已知B2的相对分子质量是A2的2倍,反应时A2与B2的质量比为3:2,符合上述条件的反应是( )
| A. | 3A2+B2═2A3B | B. | 3A2+2B2═2A3B2 | C. | A2+3B2═2AB3 | D. | 2A2+B2═2A2B |
15.下列是某学生自己总结的一些规律,其中正确的是( )
| A. | 氧化物不可能是还原产物,只可能是氧化产物 | |
| B. | 饱和溶液一定比不饱和溶液的浓度大 | |
| C. | 有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| D. | 一种元素可能有多种氧化物,但同种元素的同种化合价只有一种氧化物 |
12.下列实验对应的现象及结论均正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将过量铁粉加入稀硝酸中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向过量FeI2溶液中先滴加几滴淀粉溶液,再滴加几滴新制氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |