题目内容
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1mol甲与足量的乙完全反应共转移了1mol电子 |
| D、1.0L0.1mol?L-1戊溶液中阴离子总数为0.1NA |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:0.1 mol?L-1丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是由Z组成的单质,由发生反应可知,己不能是Na,结合原子序数可知,X为H、Z为O、W为Na元素,故己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+己,可知丙是二氧化碳,戊是碳酸钠,则Y为C,结合对应单质、化合物的性质以及题目要求可解答该题.
解答:
解:0.1 mol?L-1丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是由Z组成的单质,由发生反应可知,己不能是Na,结合原子序数可知,X为H、Z为O、W为Na元素,故己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+己,可知丙是二氧化碳,戊是碳酸钠,则Y为C,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,H原子半径最小,则原子半径大小顺序为:Na>C>O>H,即:W>Y>Z>X,故A错误;
B.Y为碳,在周期表中的位置为:第二周期第ⅣA族,故B错误;
C.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故1molNa2O2反应转移的电子为1mol×
×2=1mol,故C正确;
D.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误,
故选C.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,H原子半径最小,则原子半径大小顺序为:Na>C>O>H,即:W>Y>Z>X,故A错误;
B.Y为碳,在周期表中的位置为:第二周期第ⅣA族,故B错误;
C.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故1molNa2O2反应转移的电子为1mol×
| 1 |
| 2 |
D.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误,
故选C.
点评:本题考查元素化合物推断,题目难度中等,需要学生熟练掌握元素化合物知识,丁溶液pH值是推断突破口,对学生的逻辑推理有一定的要求,D选项注意盐类水解.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是( )
| A、电解CuSO4溶液 阴极:Cu2++2e-═Cu |
| B、电解熔融NaCl 阴极:Na++e-═Na |
| C、电解NaOH溶液 阳极:4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水 阴极:Na++e-═Na |
下列关于物质分类的说法正确的是( )
| A、化合反应均为氧化还原反应 |
| B、液氨、液氯、液体氯化氢都是非电解质 |
| C、多糖、油脂、蛋白质都是高分子化合物 |
| D、古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品 |
10g CO和H2组成的混合气体在足量氧气中完全燃烧,立即将全部生成物通入足量的Na2O2中,则固体质量增加( )
| A、10g | B、11.8g |
| C、13.2g | D、无法计算 |
标准状况下与11.2L CO2所含原子个数相同的N2的质量是( )
| A、14g | B、7g |
| C、21g | D、28g |
下列离子方程式正确的是( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、Na与CuSO4溶液反应:2Na+Cu2++2Na+ |
| D、向FeCl3溶液中加入Mg(OH)2+2Fe3+=Fe(OH)3↓+3Mg2+ |
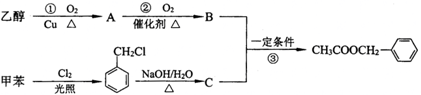
 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: