题目内容
在恒容密闭容器中发生反应2NO2?2NO+O2,下列所述可以说明反应达到平衡状态的是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变.
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变.
| A、①③ | B、②④ |
| C、①③④ | D、①②③④ |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:当可逆反应中正逆反应速率相等时,该反应达到平衡状态,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及引起的其它一系列物理量不变,据此分析解答.
解答:
解:①单位时间内生成n molO2的同时生成2n molNO2时正逆反应速率相等,则反应达到平衡状态,故正确;
②无论该反应是否达到平衡状态,只要单位时间内生成n molO2的就同时生成2n molNO,所以不能据此判断平衡状态,故错误;
③混合气体的颜色不再改变,二氧化氮浓度不变,则该反应达到平衡状态,故正确;
④该容器体积不变、气体质量不变,所以混合气体的密度始终不变,所以不能据此判断平衡状态,故错误;
故选A.
②无论该反应是否达到平衡状态,只要单位时间内生成n molO2的就同时生成2n molNO,所以不能据此判断平衡状态,故错误;
③混合气体的颜色不再改变,二氧化氮浓度不变,则该反应达到平衡状态,故正确;
④该容器体积不变、气体质量不变,所以混合气体的密度始终不变,所以不能据此判断平衡状态,故错误;
故选A.
点评:本题考查化学平衡状态的判断,只有反应前后改变的物理量才能作为判断依据,为常考查点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
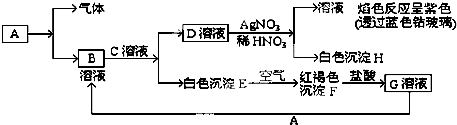
(1)试回答:写出B的化学式 C的化学式 H的化学式
(2)写出由E转变成F的化学方程式 .
(3)向G溶液加入A的有关离子反应方程式 .

(1)试回答:写出B的化学式
(2)写出由E转变成F的化学方程式
(3)向G溶液加入A的有关离子反应方程式
下列实验现象预测正确的是( )


| A、Ⅰ:振荡后静置,上层溶液颜色保持不变 |
| B、Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C、Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、Ⅳ:继续煮沸溶液一定能得到氢氧化铁胶体 |
用NaCl固体配制0.1mol?L-1的NaCl溶液,下列操作或说法正确的是( )
| A、若在移液过程中,溶液溅出容量瓶,则应重新配制溶液 |
| B、将5.85gNaCl固体溶于1 L水中可配成0.1 mol?L-1的NaCl溶液 |
| C、固体直接转移到容量瓶中,并加水稀释到刻度线 |
| D、称量时,将固体NaCl直接放在天平左盘上 |
下列关于碳酸钠与碳酸氢钠性质的比较中,正确的是( )
| A、常温时的水溶性:Na2CO3<NaHCO3 |
| B、等物质的量时与足量酸反应产生CO2的量:Na2CO3>NaHCO3 |
| C、与等浓度稀盐酸反应的快慢:Na2CO3<NaHCO3 |
| D、同质量时消耗盐酸的量:Na2CO3<NaHCO3 |
某同学利用苹果可以制作水果原电池,如图所示.下列说法正确的是( )


| A、电流计指针偏转时,说明发生了氧化还原反应 |
| B、苹果汁中无电解质 |
| C、两个电极的材料可以相同 |
| D、水果电池工作时氧化反应和还原反应在同一处进行 |
将28克铁粉溶于500mL的某稀硝酸溶液中,二者刚好完全反应,已知还原产物只有NO,且反应后的溶液比反应前增加了16克,则原硝酸浓度是( )mol/L.
| A、6.4 | B、4.8 |
| C、3.2 | D、2.4 |
 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: