题目内容
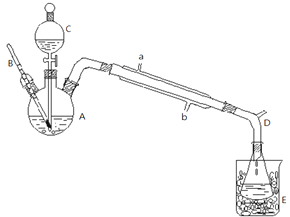
乙醚是一种用途非常广泛的有机溶剂,与空气隔绝时相当稳定.贮于低温通风处,远离火种、热源.下图是实验室制取乙醚的装置.
实验制备乙醚的化学方程式
2CH3CH2OH
CH3CH2OCH2CH3+H2O
主要试剂及产品的物理常数
可能副反应
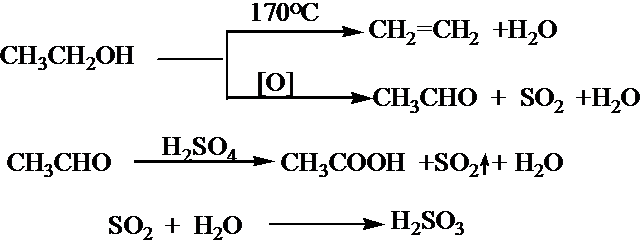
实验步聚
Ⅰ、在100mL干燥的三颈瓶A中分别加均为12mL的反应物,并将三颈瓶A浸入冰水入中冷却.
Ⅱ、装置C内盛有25mL 95%乙醇,装置C脚末端与温度计的水银球必须浸入液面以下距瓶底约0.5~1cm,加入2粒沸石,接受器浸入冰水中冷却,接尾管的支管D接橡皮管通入下水道或室外.
Ⅲ、将三颈瓶A在石棉网上加热,使反应瓶温度比较迅速上升到140℃后,开始由装置C慢慢滴加乙醇,控制滴加速度与馏出液速度大致相等(1滴/s),维持反应温度在135~145℃,约0.5h滴加完毕,再继续加热,直到温度上升到160℃,去热源停止反应,得粗产品.
Ⅳ、将馏出液转入分液漏斗,依次用8mL 5% NaOH溶液、8mL饱和NaCl溶液、8mL(两次)饱和CaCl2溶液洗涤.
V、无水氯化钙干燥至澄清,分出醚,质量为8g.
请回答相关的问题
(1)装置C的名称: ,冷凝管的进水口是 (答“a”或“b“).
(2)在步骤I中,向三颈瓶A加乙醇和浓硫酸的顺序 .
(3)接尾管的支管接橡皮管通入下水道或室外,这样做的目的是 .
(4)在步骤Ⅲ中,如果滴加乙醇的速率过快,对实验有何影响 .
(5)在步骤V中,为了得到纯净的乙醚,需采用的分离操作: .
(6)列式计算乙醚的产率: (只列式不必计算出结果).
(7)实验中用NaOH溶液除去酸性物质:醋酸和亚硫酸;用饱和氯化钙除去乙醇;用无水氯化钙干燥除去所剩的少量水和乙醇.在用NaOH溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为何要用饱和氯化钠水溶液洗涤产品. .

实验制备乙醚的化学方程式
2CH3CH2OH
| 140℃ |
主要试剂及产品的物理常数
| 名称 | 相分子质量 | 密度 g/mL | 熔点 ℃ | 沸点 ℃ | 溶解度:g/100mL溶剂 | ||
| 水 | 醇 | 醚 | |||||
| 浓H2SO4 | 98.00 | 1.84 | 10.35 | 340 | |||
| 乙醚 | 74.00 | 0.71 | -89.12 | 34.5 | 能溶 | 混溶 | 混溶 |
| 乙醇 | 46.00 | 0.780 | -114.5 | 78.4 | ∞ | ∞ | ∞ |
实验步聚
Ⅰ、在100mL干燥的三颈瓶A中分别加均为12mL的反应物,并将三颈瓶A浸入冰水入中冷却.
Ⅱ、装置C内盛有25mL 95%乙醇,装置C脚末端与温度计的水银球必须浸入液面以下距瓶底约0.5~1cm,加入2粒沸石,接受器浸入冰水中冷却,接尾管的支管D接橡皮管通入下水道或室外.
Ⅲ、将三颈瓶A在石棉网上加热,使反应瓶温度比较迅速上升到140℃后,开始由装置C慢慢滴加乙醇,控制滴加速度与馏出液速度大致相等(1滴/s),维持反应温度在135~145℃,约0.5h滴加完毕,再继续加热,直到温度上升到160℃,去热源停止反应,得粗产品.
Ⅳ、将馏出液转入分液漏斗,依次用8mL 5% NaOH溶液、8mL饱和NaCl溶液、8mL(两次)饱和CaCl2溶液洗涤.
V、无水氯化钙干燥至澄清,分出醚,质量为8g.
请回答相关的问题
(1)装置C的名称:
(2)在步骤I中,向三颈瓶A加乙醇和浓硫酸的顺序
(3)接尾管的支管接橡皮管通入下水道或室外,这样做的目的是
(4)在步骤Ⅲ中,如果滴加乙醇的速率过快,对实验有何影响
(5)在步骤V中,为了得到纯净的乙醚,需采用的分离操作:
(6)列式计算乙醚的产率:
(7)实验中用NaOH溶液除去酸性物质:醋酸和亚硫酸;用饱和氯化钙除去乙醇;用无水氯化钙干燥除去所剩的少量水和乙醇.在用NaOH溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为何要用饱和氯化钠水溶液洗涤产品.
考点:有机物的合成
专题:实验题
分析:(1)装置C为分液漏斗;采取逆流原理通入冷凝水;
(2)根据浓硫酸的稀释操作进行解答;
(3)因为乙醚容易挥发,且易燃烧,与空气混合遇明火而爆炸;
(4)乙醇来不及反应就被蒸馏出来;
(5)用蒸馏方法分离沸点相差较大的互溶液体;
(6)乙醇的总体积为37mL,根据密度、质量分数计算实际乙醇的质量,根据2CH3CH2OH~CH3OCH3计算乙醇完全反应生成乙醚的质量,即为乙醚的理论产量,进而计算乙醚的产率;
(7)因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离.
(2)根据浓硫酸的稀释操作进行解答;
(3)因为乙醚容易挥发,且易燃烧,与空气混合遇明火而爆炸;
(4)乙醇来不及反应就被蒸馏出来;
(5)用蒸馏方法分离沸点相差较大的互溶液体;
(6)乙醇的总体积为37mL,根据密度、质量分数计算实际乙醇的质量,根据2CH3CH2OH~CH3OCH3计算乙醇完全反应生成乙醚的质量,即为乙醚的理论产量,进而计算乙醚的产率;
(7)因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离.
解答:
解:(1)装置C为分液漏斗;充分利用水冷却,采取逆流原理通入冷凝水,即由b口通入冷凝水,故答案外围:分液漏斗;b;
(2)向三颈瓶A加乙醇和浓硫酸的顺序为:先加入乙醇,再慢慢倒入浓硫酸,边倒边搅拌,故答案为:先加入乙醇,再慢慢倒入浓硫酸,边倒边搅拌;
(3)因为乙醚容易挥发,且易燃烧,接尾管的支管接橡皮管通入下水道或室外,防止与空气混合遇明火而爆炸,故答案为:因为乙醚容易挥发,且易燃烧,防止与空气混合遇明火而爆炸;
(4)如果滴加乙醇的速率过快,乙醇来不及反应就被蒸馏出来,原料利用率低,故答案为:乙醇来不及反应就被蒸馏出来;
(5)乙醚与水溶液互溶,且沸点相差较大,用蒸馏方法分离,故答案为:蒸馏;
(6)乙醇的总体积为37mL,乙醇的实际质量为37mL×0.78g/mL×95%,根据2CH3CH2OH~CH3OCH3,可知乙醇完全反应生成乙醚的质量为
×37mL×0.78g/mL×95%,故乙醚的产率为
×100%,故答案为:
×100%;
(7)因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离.因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤.这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度,
故答案为:因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离.因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤.这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度.
(2)向三颈瓶A加乙醇和浓硫酸的顺序为:先加入乙醇,再慢慢倒入浓硫酸,边倒边搅拌,故答案为:先加入乙醇,再慢慢倒入浓硫酸,边倒边搅拌;
(3)因为乙醚容易挥发,且易燃烧,接尾管的支管接橡皮管通入下水道或室外,防止与空气混合遇明火而爆炸,故答案为:因为乙醚容易挥发,且易燃烧,防止与空气混合遇明火而爆炸;
(4)如果滴加乙醇的速率过快,乙醇来不及反应就被蒸馏出来,原料利用率低,故答案为:乙醇来不及反应就被蒸馏出来;
(5)乙醚与水溶液互溶,且沸点相差较大,用蒸馏方法分离,故答案为:蒸馏;
(6)乙醇的总体积为37mL,乙醇的实际质量为37mL×0.78g/mL×95%,根据2CH3CH2OH~CH3OCH3,可知乙醇完全反应生成乙醚的质量为
| 74 |
| 92 |
| 8g | ||
|
| 8g | ||
|
(7)因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离.因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤.这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度,
故答案为:因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离.因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤.这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度.
点评:本题考查有机物合成实验,是对基础知识的综合考查,需要学生具备扎实的基础与分析处理问题的能力,难度中等.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
对于可逆反应:FeO(s)+CO(g)?Fe(s)+CO2(g)在一定温度下其平衡常数K,下列条件变化中,能使K发生变化的是( )
| A、增大FeO(s)表面积 |
| B、增大体系压强 |
| C、升高体系温度 |
| D、使用适合的催化剂 |
某研究性小组讨论甲乙丙丁四种仪器的用法,其中合理的是( )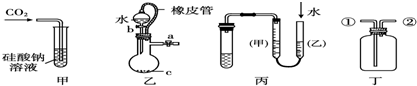

| A、甲装置:可用来证明碳酸的酸性比硅酸强 |
| B、乙装置:c为二氧化硅可制硅酸 |
| C、丙装置:可进行氢氟酸与二氧化硅的反应并测定气体体积 |
| D、丁装置:从②口进气可用于收集二氧化碳 |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%.其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
| A、2mol C |
| B、2molA、1molB和1molHe(不参加反应) |
| C、1molB和1molC |
| D、2molA、3molB和3molC |
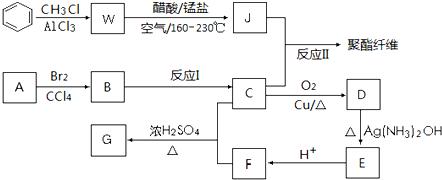
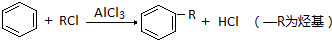



 )的合成路线(不超过四步)(合成路线常用的表示方式为:A
)的合成路线(不超过四步)(合成路线常用的表示方式为:A 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: