题目内容
用NaCl固体配制0.1mol?L-1的NaCl溶液,下列操作或说法正确的是( )
| A、若在移液过程中,溶液溅出容量瓶,则应重新配制溶液 |
| B、将5.85gNaCl固体溶于1 L水中可配成0.1 mol?L-1的NaCl溶液 |
| C、固体直接转移到容量瓶中,并加水稀释到刻度线 |
| D、称量时,将固体NaCl直接放在天平左盘上 |
考点:配制一定物质的量浓度的溶液
专题:
分析:A.若在移液过程中,溶液溅出容量瓶,溶质的物质的量偏小,实验失败;
B.天平的准确度为0.1g,氯化钠溶于1L水后溶液的体积不是1L;
C.容量瓶为精密仪器,不能用来溶解固体;
D.药品不能直接放在托盘内,应放在称量纸上或玻璃器皿中.
B.天平的准确度为0.1g,氯化钠溶于1L水后溶液的体积不是1L;
C.容量瓶为精密仪器,不能用来溶解固体;
D.药品不能直接放在托盘内,应放在称量纸上或玻璃器皿中.
解答:
解:A.在移液过程中,溶液溅出容量瓶,溶质的物质的量偏小,实验失败,必须重新配制,故A正确;
B.托盘天平的准确度为0.1g,称量时只能称量5.9g氯化钠;将氯化钠溶于1L水得到的溶液体积不是1L,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,应先在烧杯中溶解,故C错误;
D.称取氯化钠固体,应放在滤纸上称量,故D错误;
故选:A.
B.托盘天平的准确度为0.1g,称量时只能称量5.9g氯化钠;将氯化钠溶于1L水得到的溶液体积不是1L,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,应先在烧杯中溶解,故C错误;
D.称取氯化钠固体,应放在滤纸上称量,故D错误;
故选:A.
点评:本题考查一定物质的量浓度溶液的配制,明确配制原理是解题关键,注意托盘天平和容量瓶的正确使用方法.

练习册系列答案
相关题目
检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42- |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
| D、加浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH4+ |
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A、c(HCOO-)>c(Na+) |
| B、c(HCOO-)<c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、无法确定c(HCOO-)与c(Na+)的关系 |
下列实验装置设计正确、且能达到目的是( ) 

| A、实验Ⅰ:静置一段时间,小试管内有晶体析出 |
| B、实验Ⅱ:制取O2 |
| C、实验Ⅲ:除CO2气体中的HCl |
| D、实验Ⅳ:配制一定物质的量浓度的稀硫酸 |
在恒容密闭容器中发生反应2NO2?2NO+O2,下列所述可以说明反应达到平衡状态的是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变.
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变.
| A、①③ | B、②④ |
| C、①③④ | D、①②③④ |
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是( )
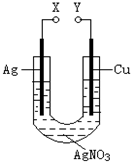

| A、X和Y不连接时,铜棒上会有金属银析出 |
| B、X和Y用导线连接时,银棒是正极,发生氧化反应 |
| C、若X接直流电源的正极,Y接负极,Ag+向铜电极移动 |
| D、无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |