题目内容
4. 硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.
硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.回答下列问题:
(1)H2S可用FeCl3溶液、NaClO溶液及氨水等吸收.
①FeCl3溶液吸收H2S气体,该反应的还原产物为Fe2+.
②NaClO溶液吸收H2S,氧化剂与还原剂的物质的量之比为4:1,则该反应的离子方程式为4ClO-+H2S═4Cl-+2H++SO42-
(2)Linkkous等学者通过多硫化物作循环液,设计出如下四步反应:
(Ⅰ)H2S+OH-═HS-+H2O
(Ⅱ)2HS-$→_{光催化剂}^{光}$H2↑+S22-
(Ⅲ)H2S+S22-═2HS-+S↓
(Ⅳ)HS-+H2O═H2S+OH-
四步反应的总反应的化学方程式为H2S$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{光催化剂}$H2↑+S↓;能量转化方式为光能转化为化学能.
(3)克劳斯法脱硫包含的反应为:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(1)△H1
2H2S(g)+SO2(g)═3S(s)+2H2O(1)△H2
H2S(g)+$\frac{1}{2}$O2(g)═SO2(s)+H2O(1)△H3
①△H3=$\frac{△{H}_{1}+2△{H}_{2}}{6}$(用△H1、△H2表示).
②为了达到较好的脱硫率,除采用多级脱硫外,还可采取的措施是
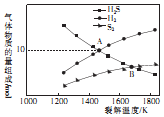
(4)硫化氢裂解制氢气的反应为2H2S(g)═S2 (g)+2H2(g),设起始时容器中只有H2S,平衡时三种物质的组成与裂解温度关系如图所示.
①A点时,H2S的转化率为50%.
②B点时,设容器的总压为p Pa,则平衡常数Kp为$\frac{5}{3}$pPa (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
分析 (1)①在氧化还原反应中,化合价降低的元素在反应中被还原,发生还原反应,其产物为还原产物,氯化铁具有氧化性氧化硫化氢为硫单质,自身还原为亚铁离子;
②NaClO溶液吸收H2S,氧化剂为NaClO,还原剂为H2S,氧化剂与还原剂的物质的量之比为4:1,根据得失电子守恒计算;
(2)将Ⅰ、Ⅱ、Ⅲ、Ⅳ四反应相加得到总反应;能量转化方式为光能转化为化学能;
(3)①根据已知方程式构建目标方程式,根据盖斯定律进行计算;
②控制反应物的物质的量之比等于反应方程式中化学计量数之比;
(4)①A点H2S的物质的量为10mol,氢气为10mol,根据反应方程式计算H2S的转化率;
②B点H2S与S2 物质的量相等,分压=总压×物质的量分数,据此计算.
解答 解:(1)①氯化铁具有氧化性氧化硫化氢为硫单质,反应的离子方程式为:2Fe3++H2S═2Fe2++2H++S↓,铁元素的化合价降低,发生还原反应,其产物Fe2+为还原产物,
故答案为:Fe2+;
②NaClO溶液吸收H2S,以NaClO氧化H2S,反应中氧化剂与还原剂的物质的量之比为4:1,反应为4NaClO+H2S═4NaCl+H2SO4,离子方程式为:4ClO-+H2S═4Cl-+2H++SO42-,
故答案为:4ClO-+H2S═4Cl-+2H++SO42-;
(2)(Ⅰ)H2S+OH-═HS-+H2O
(Ⅱ)2HS-$→_{光催化剂}^{光}$H2↑+S22-
(Ⅲ)H2S+S22-═2HS-+S↓
(Ⅳ)HS-+H2O═H2S+OH-
将Ⅰ+Ⅱ+Ⅲ+Ⅳ得到H2S$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{光催化剂}$H2↑+S↓,四步反应中光能提供能量,转化为化学能,
故答案为:H2S$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{光催化剂}$H2↑+S↓;光能转化为化学能;
(3)①Ⅰ2H2S(g)+3O2(g)═2SO2(g)+2H2O(1)△H1
Ⅱ2H2S(g)+SO2(g)═3S(s)+2H2O(1)△H2
将(Ⅰ+Ⅱ×2)×$\frac{1}{6}$得H2S(g)+$\frac{1}{2}$O2(g)═SO2(s)+H2O(1),则根据盖斯定律可得:△H3=$\frac{△{H}_{1}+2△{H}_{2}}{6}$,
故答案为:$\frac{△{H}_{1}+2△{H}_{2}}{6}$;
②H2S(g)+$\frac{1}{2}$O2(g)═SO2(s)+H2O(1),当$\frac{n({H}_{2}S)}{n({O}_{2})}$=$\frac{1}{\frac{1}{2}}$=2时,可达到较好的脱硫率,
故答案为:控制$\frac{n({H}_{2}S)}{n({O}_{2})}$═2;
(4)①A点H2S的物质的量为10mol,氢气为10mol,2H2S(g)═S2 (g)+2H2(g),生成10mol氢气,分解的硫化氢10mol,则H2S的转化率为$\frac{10mol}{10mol+10mol}$=50%,
故答案为:50%;
②设变化的硫化氢的物质的量为x,
2H2S(g)═S2 (g)+2H2(g),
始 20
变 x $\frac{1}{2}$x x
终 20-x $\frac{1}{2}$x x
B点H2S与S2 物质的量相等,20-x=$\frac{1}{2}$x,解得x=$\frac{40}{3}$,则反应后的总物质的量为反应前的物质的量之比为$\frac{20+\frac{40}{3}}{20}$=$\frac{5}{3}$pPa,
故答案为:$\frac{5}{3}$pPa.
点评 本题考查氧化还原反应,侧重反应产物的判断、盖斯定律的应用、方程式的书写,掌握相关知识是解答关键,题目难度中等.

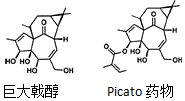 2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )
2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )| A. | 由巨大戟醇制备Picato药物的另一种反应物是(CH3)2C=CHCOOH | |
| B. | 巨大戟醇能发生取代反应、氧化反应、加成反应 | |
| C. | 巨大戟醇和Picato药物都不属于芳香族化合物 | |
| D. | 0.1mol巨大戟醇完全燃烧消耗2.45molO2 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 聚氯乙烯塑料广泛应用于塑料薄膜、食品包装袋等 | |
| C. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 |
| A. | C4H8 | B. | C6H6 | C. | C2H5Cl | D. | C2H4Cl2 |
| A. | ⅢB族 | B. | ⅢA族 | C. | ⅤⅢ族 | D. | 0族 |
| A. | H2C=CHCH3分子中所有原子在同一平面上 | |
| B. | 分子式为C3H5Br3的有机物共有5种同分异构体(不含立体异构) | |
| C. | 乙二醇和甘油互为同系物 | |
| D. | 结构式为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B |  | 反应结束后,锥形瓶中溶液的溶质是Cu(NO3)2、CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)>Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 若X的最高价含氧酸为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若Y的最高正价为+m,则X的最高正价一定为+m | |
| C. | 若X元素形成的单质是X2,则Y形成的单质一定是Y2 | |
| D. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| A. | O2 | B. | NO2 | C. | NO | D. | SO2 |