题目内容
13.有X、Y两种元素,原子序数≤20,X的原子序数小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )| A. | 若X的最高价含氧酸为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若Y的最高正价为+m,则X的最高正价一定为+m | |
| C. | 若X元素形成的单质是X2,则Y形成的单质一定是Y2 | |
| D. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
分析 X的原子序数小于Y,X、Y原子的最外层电子数相同,说明位于同一主族,根据同主族元素性质的递变规律解答该题.
解答 解:A.若HnXOm为硝酸,则X的氢化物为氨气,为碱性气体,溶于水呈碱性,故A错误;
B.若Y的最高正价为+m,X不一定有正价,如Cl的最高正价为+7价,而F的最高价为0价,故B错误;
C.若X形成的单质是N2,则Y元素形成的单质可以是红磷或者白磷,白磷的分子式为P4,故C错误;
D.如X、Y为金属元素,同主族元素从上到下元素的金属性逐渐增强,对应的最高价氧化物的水化物的碱性逐渐增强,故D正确.
故选D.
点评 本题考查原子结构与元素周期律,为高考常见题型和高频考点,侧重考查学生的分析能力,题目难度不大,本题注意同主族元素性质的递变规律,特别注意化合价等问题.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
10.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | Na2O2和KMnO4分别制得1molO2转移的电子数均是4NA | |
| B. | 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA | |
| C. | 若1L 0.2mol/L的FeCl3溶液完全水解形成胶体,则胶体微粒数为0.2NA | |
| D. | 用惰性电极电解1L0.lmol•L-1的食盐水,两极共收集到0.28mol的气体,则电路中转移电子数为0.34NA(不考虑气体的溶解) |
1.化学与壮会、生活密切相关.对下列现象或事实的解释不正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 有浸有高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 用氢氟酸蚀刻玻璃 | SiO2虽然是酸性氧化物,但能溶于氢氟酸 |
| C | 常温下,可用铁、铝制容器盛装浓硫酸或浓硝酸 | 铁表面被氧化为致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
8.设NA为阿伏加德罗常数的值,下列有关叙述错误的是( )
| A. | 1mol H2O2与足量KMnO4反应,转移电子数为2NA | |
| B. | 4.4g CO2和N2O的混合气体含有的原子数为0.3NA | |
| C. | 22.4L NH3含有的电子数为10NA | |
| D. | 25℃、101kPa,2.24LCH4含有的共价键数小于0.4NA |
18.物质的鉴别有多种方法.下列能达到鉴别目的是( )
①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 ③点燃鉴别甲烷
和乙烯 ④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用碳酸钠溶液鉴別酒精、醋酸、油脂.
①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 ③点燃鉴别甲烷
和乙烯 ④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用碳酸钠溶液鉴別酒精、醋酸、油脂.
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ①②③ |
5.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 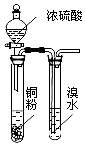 用图所示装置验证浓硫酸具有强氧化性 | |
| B. | 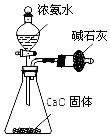 用图所示装罝制取干燥的 NH3 | |
| C. | 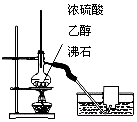 用图所示装置制取并收集乙烯 | |
| D. | 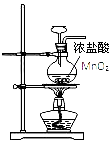 用图所示装置制取 Cl2 |
2.四种短周期主族元素W、X、Y、Z、M的原子序数依次增大,W的原子中只有1个电子,X2-和Y+离子的电子层结构相同,Z与X同族,M与Y形成的离子化合物的水溶液呈中性.下列叙述错误的是( )
| A. | W与其他四种元素形成的二元化合物中其化合价均为+1 | |
| B. | X与Y形成的化合物溶于水后溶液呈碱性 | |
| C. | 最高价氧化物的水化物的酸性:M>Z | |
| D. | 简单离子半径:W<Y<X<Z |
17.化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 煤是混合物,含有大量的芳香烃 |
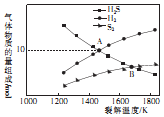 硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.
硫化氢是天然气及石油中的含硫杂质,近年来发现H2S可用于高效制取氢气.