题目内容
8.在浓硝酸中放入铜片:(1)开始反应的化学方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,实验现象为铜片逐渐变小,表面有气泡生成,溶液颜色变成蓝绿色,并有红棕色气体产生.
(2)若铜有剩余,则反应将要结束时的反应方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是稀硫酸中氢离子和硝酸铜中硝酸根离子又构成硝酸,和铜继续反应.
(4)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生5.6L(标准状况)气体.则所消耗的HNO3的物质的量为0.65mol,其中显氧化性的硝酸的物质的量为0.25mol.
分析 (1)Cu与浓硝酸反应生成二氧化氮和硝酸铜溶液;
(2)浓硝酸随反应的进行变为稀硝酸,则反应快结束时铜和稀硝酸反应生成NO;
(3)硝酸盐在酸性条件下具有硝酸的氧化性,则能继续与铜反应;
(4)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,显氧化性的硝酸的物质的量和产生气体的物质的量相等,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量.
解答 解:(1)因反应开始硝酸的浓度大,反应剧烈,反应生成硝酸铜溶液、二氧化氮和水,其反应方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,现象为:铜片逐渐变小,表面有气泡生成,溶液颜色变成蓝绿色,并有红棕色气体产生.
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;铜片逐渐变小,表面有气泡生成,溶液颜色变成蓝绿色,并有红棕色气体产生;
(2)浓硝酸随反应的进行变为稀硝酸,则反应快结束时铜和稀硝酸反应生成NO,其离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)硝酸盐在酸性条件下具有硝酸的氧化性,则能与铜与氢离子、硝酸根离子继续反应生成NO,
故答案为:稀硫酸中氢离子和硝酸铜中硝酸根离子又构成硝酸,和铜继续反应;
(4)12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;其中显氧化性的硝酸的物质的量和产生气体的物质的量相等,即0.25mol,
故答案为:0.65 mol;0.25 mol.
点评 本题考查硝酸的性质和硝酸盐在酸性条件下的性质,明确铜与浓、稀硝酸反应的化学反应即可解答,题目难度不大.

| A. | 皂化反应 | B. | 焰色反应 | C. | 水解反应 | D. | 钝化反应 |
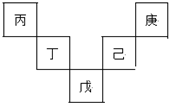 已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )
已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 常温下,庚的单质能与水反应产生气体 | |
| C. | 气态氢化物的稳定性:庚<己<戊 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
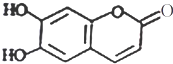
| A. | M的摩尔质量是178 | |
| B. | 1 mol M最多能与2mol Br2发生反应 | |
| C. | 1mol M与足量NaHCO3反应能生成2 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |

| A. | CuSO4溶液的n(SO42-)保持不变 | B. | U型管中溶液pH值逐渐变小 | ||
| C. | CuSO4溶液的c(Cu2+)逐渐减小 | D. | X是正极,Y是负极 |
| A. | 它的中子数是175 | B. | 它是第七周期元素 | ||
| C. | 它是活泼的金属元素 | D. | 它的最外层电子数是8 |