题目内容
18.美国劳仑斯国家实验室曾在1999年宣布用86Kr离子轰击208Pb靶得到118号元素的一种原子,其质量数为293.其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文.但是科学家们相信,完成的第七周期包含的元素数目与第六周期相同.若118号元素将来被确认,则下列预测不合理的是 ( )| A. | 它的中子数是175 | B. | 它是第七周期元素 | ||
| C. | 它是活泼的金属元素 | D. | 它的最外层电子数是8 |
分析 A.118号元素的一种原子,其质量数为293,中子数=质量数-质子数;
B.位于第七周期0族;
C.为稀有气体;
D.完成的第七周期包含的元素数目与第六周期相同,为32种元素,第六周期稀有气体的原子序数为86.
解答 解:A.118号元素的一种原子,质子数为118,其质量数为293,中子数=293-118=175,故A正确;
B.由选项B分析可知,位于第七周期0族,故B正确;
C.由选项B分析可知,为稀有气体,故C错误;
D.完成的第七周期包含的元素数目与第六周期相同,为32种元素,第六周期稀有气体的原子序数为86,则该元素位于第七周期0族,最外层电子数为8,故D正确;
故选C.
点评 本题考查元素的位置与原子序数的关系,注意第六周期的0族元素的原子序数为32,结合习题中的信息推断元素的位置为解答的关键,题目难度不大.

练习册系列答案
相关题目
9.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 39g钾与足量氧气充分反应,转移的电子数一定是NA |
6.决定元素种类的微粒是( )
| A. | 质量数 | B. | 中子数 | C. | 核外电子数 | D. | 质子数 |
3.某元素X最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中X元素的化合价为( )
| A. | -(3n-4) | B. | (3n-12) | C. | -(12-3n) | D. | -(n-10) |
10.今有A、B、C三种元素,A、C元素原子的最外层电子数分别为6、2,B元素原子最外层电子数是内层电子数的2倍,A原子比B原子多一个电子层,C原子比B原子少一个电子层,这三种元素分别是( )
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
7.某溶液含有K+,Fe3+、SO42-、CO32-、I-中的一种或几种.取样,滴加KSCN溶液后显红色,为确定该溶液组成,还需检验的离子是( )
| A. | K+ | B. | I- | C. | SO42- | D. | CO32- |
8.A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C常用作F的检验(加热).请填写下列空白:
(1)F粒子的电子式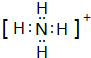 .
.
(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C加热时反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)F粒子的电子式
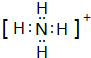 .
.(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C加热时反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.