题目内容
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,下列说法错误的是( )
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜镀层放出2.24L H2 |
考点:电解原理
专题:电化学专题
分析:A、电镀池中,镀件是阴极,在阴极上发生还原反应;
B、电解池中,阳离子移向阴极,阴极上发生得电子的还原反应;
C、在电解池的阳极上发生失电子的氧化反应;
D、根据电解池中的电极反应式结合电子守恒来计算.
B、电解池中,阳离子移向阴极,阴极上发生得电子的还原反应;
C、在电解池的阳极上发生失电子的氧化反应;
D、根据电解池中的电极反应式结合电子守恒来计算.
解答:
解:A、电镀池中,镀件是阴极,氢离子可以在阴极上发生还原反应析出氢气,故A正确;
B、电解池中,阳离子Cu2+移向阴极,并在阴极上发生还原反应,故B正确;
C、根据反应:Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,在阳极上是甲醛发生失电子的氧化反应,即HCHO+3OH--2e-=2H2O+HCOO-,故C正确;
D、电镀时,在阴极上析出Cu,Cu2++2e-=Cu,每生成6.4g铜,转移电子是0.2mol,减少铜离子是0.1mol,根据反应Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,在该极上会生成氢气0.1mol,标况下的体积是2.24L,故D错误.
故选D.
B、电解池中,阳离子Cu2+移向阴极,并在阴极上发生还原反应,故B正确;
C、根据反应:Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,在阳极上是甲醛发生失电子的氧化反应,即HCHO+3OH--2e-=2H2O+HCOO-,故C正确;
D、电镀时,在阴极上析出Cu,Cu2++2e-=Cu,每生成6.4g铜,转移电子是0.2mol,减少铜离子是0.1mol,根据反应Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,在该极上会生成氢气0.1mol,标况下的体积是2.24L,故D错误.
故选D.
点评:本题涉及电镀池的工作原理以及电子守恒的有关计算知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列措施中不能 起到节能降耗和保护环境目的是( )
| A、加大太阳能、水能、风能、地热能等能源开发力度,减少化石燃料的使用 |
| B、研制乙醇汽油技术,降低机动车辆尾气中有害气体排放 |
| C、生产、生活中,努力实现资源的循环利用 |
| D、利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求 |
利用某有机物之间的转换可以贮存太阳能,如降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为: △H=+88.62kJ/mol
△H=+88.62kJ/mol
下列有关说法不正确的是( )
 △H=+88.62kJ/mol
△H=+88.62kJ/mol下列有关说法不正确的是( )
| A、一定条件下,1mol NBD最多可与2 mol Br2发生加成反应 |
| B、物质Q的能量比NBD的低 |
| C、物质Q的一氯取代物只有3种 |
| D、NBD和Q二者互为同分异构体 |
下列叙述中正确的是( )
| A、元素电负性越大,元素第一电离能越大 |
| B、键能越大,键长越长,共价化合物越稳定 |
| C、副族元素中没有非金属元素 |
| D、离子化合物的熔点一定比共价化合物的高 |
以下分子或离子的结构为正四面体且键与键之间夹角为109°28′的是( )
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤金刚石.
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤金刚石.
| A、①②④ | B、①②③④⑤ |
| C、①② | D、①②⑤ |
以下是一些分子的比例模型,其中错误的是( )
A、 HCl |
B、 CO2 |
C、 NH3 |
D、 CH4 |
高温电解石灰石生产CaO的工作原理如图.下列说法不正确的是( )


| A、CO32-向阳极移动 |
| B、阴极电极反应式为3CO2+4e-═C+2CO32- |
| C、该装置可实现太阳能直接转化为化学能 |
| D、该装置可实现CO2零排放 |
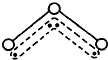 O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答: 某反应2A(g)?2B(g)+C(g)(吸热反应)在2L密闭容器中的三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示
某反应2A(g)?2B(g)+C(g)(吸热反应)在2L密闭容器中的三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示