题目内容
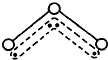 O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:(1)臭氧与氧气的关系是
(2)选出下列分子中与O3分子属于等电子体的是
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有
(4)O3与O2间的转化是否为氧化还原反应
考点:臭氧
专题:氧族元素
分析:(1)同种元素组成的不同的单质互为同素异形体;
(2)等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团;
(3)根据孤对电子的概念及臭氧分子结构分析;
(4)氧化还原反应有化合价的变化.
(2)等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团;
(3)根据孤对电子的概念及臭氧分子结构分析;
(4)氧化还原反应有化合价的变化.
解答:
解:(1)臭氧与氧气都是由氧元素组成的不同单质,二者互为同素异形体,
故答案为:同素异形体;
(2)O3分子中含有3个原子,价电子数为18.
A.H2O中价电子数为10,不等于18,故A错误;
B.CO2 中价电子数为16,不等于18,故B错误;
C.O3和SO2原子数相等,价电子数都是18,所以它们是等电子体,故C正确;
D.BeCl2,价电子数为16,不等于18,故D错误;
故选:C;
(3)臭氧分子中,中间的氧原子含有1对孤电子对,两边的各含有2对孤电子对,所以总共5对孤电子对,
故答案为:5;
(4)氧气和臭氧中氧元素的化合价都是0价,反应过程中没有化合价的变化,不属于化学变化,故答案为:否.
故答案为:同素异形体;
(2)O3分子中含有3个原子,价电子数为18.
A.H2O中价电子数为10,不等于18,故A错误;
B.CO2 中价电子数为16,不等于18,故B错误;
C.O3和SO2原子数相等,价电子数都是18,所以它们是等电子体,故C正确;
D.BeCl2,价电子数为16,不等于18,故D错误;
故选:C;
(3)臭氧分子中,中间的氧原子含有1对孤电子对,两边的各含有2对孤电子对,所以总共5对孤电子对,
故答案为:5;
(4)氧气和臭氧中氧元素的化合价都是0价,反应过程中没有化合价的变化,不属于化学变化,故答案为:否.
点评:本题为综合题,考查知识点比较多,涉及到同素异形体的判断,等电子体的概念,臭氧的分子结构,氧化还原反应的判断,难度中等,注意结合相关知识解答,易错点为等电子体的判断,准确理解等电子体的概念是解题的关键.

练习册系列答案
相关题目
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,下列说法错误的是( )
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜镀层放出2.24L H2 |
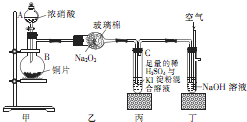 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.