题目内容
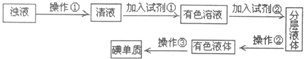
 某反应2A(g)?2B(g)+C(g)(吸热反应)在2L密闭容器中的三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示
某反应2A(g)?2B(g)+C(g)(吸热反应)在2L密闭容器中的三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示(1)在实验①、②中有一个使用了催化剂,根据图中的数据判断可知实验
(2)实验①、③的反应条件中只有温度不同,则③的反应T
(3)从开始到6min时,实验③中B物质的平均反应速率为
(4)在一定条件下,对于恒容密闭容器中进行的反应2A(g)?2B(g)+C(g),下列说法中能够说明反应达到平衡状态的是
A.反应容器内的气体A、B、C物质的量的浓度之比为2:2:1
B.反应容器内的压强不再随时间的变化而变化
C.此时单位时间内每消耗2mol A,同时有1mol C生成
D.混合体系的密度不再随时间的变化而变化.
考点:物质的量或浓度随时间的变化曲线,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据达到平衡所用时间来判断,加催化剂反应速率加快;
(2)根据达到平衡所用时间来判断;
(3)实验③中,从开始到平衡状态A的物质的量变化为4.5mol-1.5mol=3mol,再根据v(A)=
计算,再根据计量数关系求出v(B);根据消耗的A的浓度求出C的浓度;根据转化率的公式计算;
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
(2)根据达到平衡所用时间来判断;
(3)实验③中,从开始到平衡状态A的物质的量变化为4.5mol-1.5mol=3mol,再根据v(A)=
| △c |
| △t |
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答:
解:(1)由图可知,实验②到达平衡所用时间比实验①短,说明实验②条件下反应速率快,加催化剂反应速率加快,则实验②使用了催化剂;
故答案为:②;
(2)由图可知,实验③到达平衡所用时间比实验①短,说明实验③条件下反应速率快,升高温度加快反应速率,所以实验③时的温度T>500K;
故答案为:>;
(3)实验③中,从开始到平衡状态A的浓度变化为4.5mol-1.5mol=3mol,则△c(A)=
=
=1.5mol/L,v(A)=
=
=0.25mol/(L?min),则v(B)=0.25mol/(L?min);反应生成C的浓度为c(C)=
△c(A)=0.75mol/L;A的转化率为
×100%=66.67%;
故答案为:0.25mol/(L?min);0.75mol/L;66.67%;
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,
A.反应达到化学平衡状态时,反应容器内的气体A、B、C物质的量的浓度保持不变,但是浓度之比不能确定,不一定是2﹕2﹕1,故A错误;
B.反应后气体的物质的量增大,则压强增大,所以反应容器内的压强不再随时间的变化而变化时,反应达到平衡状态,故B正确;
C.单位时间内每消耗2mol A,同时有1mol C生成,都表示正速率,不能说明反应到达平衡状态,故C错误;
D.容器的体积不变即气体的体积不变,气体的质量守恒,则混合体系的密度始终不变,所以密度不再随时间的变化而变化,不能说明反应到达平衡状态,故D错误;
故答案为:B.
故答案为:②;
(2)由图可知,实验③到达平衡所用时间比实验①短,说明实验③条件下反应速率快,升高温度加快反应速率,所以实验③时的温度T>500K;
故答案为:>;
(3)实验③中,从开始到平衡状态A的浓度变化为4.5mol-1.5mol=3mol,则△c(A)=
| △n |
| V |
| 3mol |
| 2L |
| △c |
| △t |
| 1.5mol/L |
| 6min |
| 1 |
| 2 |
| 3mol |
| 4.5mol |
故答案为:0.25mol/(L?min);0.75mol/L;66.67%;
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,
A.反应达到化学平衡状态时,反应容器内的气体A、B、C物质的量的浓度保持不变,但是浓度之比不能确定,不一定是2﹕2﹕1,故A错误;
B.反应后气体的物质的量增大,则压强增大,所以反应容器内的压强不再随时间的变化而变化时,反应达到平衡状态,故B正确;
C.单位时间内每消耗2mol A,同时有1mol C生成,都表示正速率,不能说明反应到达平衡状态,故C错误;
D.容器的体积不变即气体的体积不变,气体的质量守恒,则混合体系的密度始终不变,所以密度不再随时间的变化而变化,不能说明反应到达平衡状态,故D错误;
故答案为:B.
点评:本题考查反应速率计算、外界条件对平衡的影响、化学平衡图象等,题目难度中等,注意分析图象中曲线的拐点所代表的含义是解决本题的关键.

练习册系列答案
相关题目
化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A、处理废弃塑料制品较为合理的方法是使用化学方法把它加工成防水涂料或汽油等物质 |
| B、研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染 |
| C、新型材料聚酯纤维、光导纤维都属于有机高分子 |
| D、工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染 |
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,下列说法错误的是( )
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜镀层放出2.24L H2 |
在一定温度下,可逆反应X(气)+3Y(气)?2Z(气)达到平衡的标志是( )
| A、单位时间生成amolX,同时生成2a molZ |
| B、V正(Y)=V逆(Z) |
| C、c(X):c(Y):c(Z)=1:3:2 |
| D、c(Y)=c(Z) |
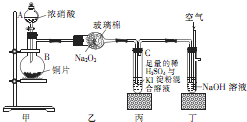 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.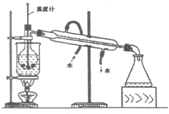 实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)
实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)