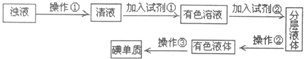
题目内容
下列叙述中正确的是( )
| A、元素电负性越大,元素第一电离能越大 |
| B、键能越大,键长越长,共价化合物越稳定 |
| C、副族元素中没有非金属元素 |
| D、离子化合物的熔点一定比共价化合物的高 |
考点:元素周期律的作用,元素周期表的结构及其应用,键能、键长、键角及其应用
专题:元素周期律与元素周期表专题
分析:A、元素的电负性大,第一电离能不一定大,如N的第一电离能高于O元素的第一电离能;
B、键长越长,键能应该越小;
C、根据元素周期表可知副族元素中没有非金属元素;
D、离子化合物的熔点不一定比共价化合物的高,例如氯化钠是离子化合物,熔点801℃,二氧化硅是共价化合物,熔点1670℃.
B、键长越长,键能应该越小;
C、根据元素周期表可知副族元素中没有非金属元素;
D、离子化合物的熔点不一定比共价化合物的高,例如氯化钠是离子化合物,熔点801℃,二氧化硅是共价化合物,熔点1670℃.
解答:
解:A、N元素的电负性小于氧元素的电负性,但N元素原子2p能级为半满稳定状态,第一电离能大于O元素,故A错误;
B、键能越大,键长越短,共价化合物越稳定,故B错误;
C、根据元素周期表可知副族元素中没有非金属元素,故C正确;
D、氯化钠是离子化合物,熔点801℃,二氧化硅是共价化合物,熔点1670℃,故D错误.
故选:C.
B、键能越大,键长越短,共价化合物越稳定,故B错误;
C、根据元素周期表可知副族元素中没有非金属元素,故C正确;
D、氯化钠是离子化合物,熔点801℃,二氧化硅是共价化合物,熔点1670℃,故D错误.
故选:C.
点评:本题考查电负性、第一电离能的递变规律以及熔点大小判断,难度不大,注意规律中的特殊性,注意副族元素.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
以下说法正确的是( )
| A、物质所含元素化合价升高的反应叫还原反应 |
| B、还原剂中必定有一种元素被氧化 |
| C、物质中某元素失去电子,则此物质是氧化剂 |
| D、在氧化还原反应中,失去电子的元素化合价降低 |
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-═Cu↓+H2↑+2H2O+2HCOO-,下列说法错误的是( )
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜镀层放出2.24L H2 |
下列关于卤素的叙述正确的是( )
| A、卤素只以化合态存在于自然界中 |
| B、随核电荷数增加,单质熔沸点降低 |
| C、随核电荷数增加,单质氧化性增强 |
| D、单质与水反应的通式均为X2+H2O=HX+HXO |
下列说法正确的是( )
| A、含有共价键的物质一定是共价化合物 |
| B、只含有共价键的物质一定是共价化合物 |
| C、离子化合物中可能含有共价键 |
| D、氦分子中含有共价键 |
X、Y是元素周期表中的两种元素.下列叙述中能说明X的非金属性比Y强的是( )
| A、X的气态氢化物比Y的气态氢化物稳定 |
| B、X氢化物水溶液的酸性比Y的氢化物水溶液的酸性强 |
| C、达8电子结构时X原子得到电子数比Y多 |
| D、Y的单质能将X从NaX 的溶液中置换出来 |
 实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)
实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)