题目内容
8.下列条件下,两瓶气体所含的原子数一定相等的是( )①同质量、不同密度的Cl2和CO ②同温度、同体积的H2和 N2
③同体积、同密度的 C2H4和C3H6两种气体 ④同压强、同体积的N2O 和 CO2两种气体.
| A. | ①③ | B. | ③ | C. | ③④ | D. | ②④ |
分析 根据N=nNA可知,气体中含有原子的物质的量相等时,所含的原子数一定相等,分别根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算出气体的物质的量,然后结合分子组成计算.
解答 解:根据N=nNA可知,气体中含有原子的物质的量相等时,所含的原子数一定相等,
①同质量、不同密度的Cl2和CO,根据n=$\frac{m}{M}$可知,二者的摩尔质量不同,则等质量时二者的物质的量不相等,含有原子的物质的量、数目不相等,故①错误;
②同温度、同体积的H2和 N2,没有告诉压强,二者的气体摩尔体积不一定相等,则二者的物质的量不一定相等,故②错误;
③同体积、同密度的 C2H4和C3H6两种气体,根据m=ρV可知二者的质量相等,由于二者的最简式都是CH2,则等质量的二者含有原子的物质的量、数目越大相等,故③正确;
④同压强、同体积的N2O 和 CO2两种气体,没有告诉温度,二者的气体摩尔体积不一定相等,则无法计算二者的物质的量,故④错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确气体摩尔体积的使用条件为解答关键,注意掌握物质的量与其它物理量之间的转化关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)若NH3?$\frac{1}{2}$N2+$\frac{3}{2}$H2 K=a,则N2+3H2?2NH3 K′=$\frac{1}{{a}^{2}}$.(用含a的式子表示)
(3)在体积为3L的恒容密闭容器中,合成氨N2+3H2?2NH3实验,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量.
①则T1<T2(填“>”、“<”或“=”)
②在T2下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.
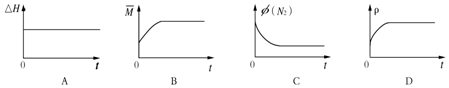
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)若NH3?$\frac{1}{2}$N2+$\frac{3}{2}$H2 K=a,则N2+3H2?2NH3 K′=$\frac{1}{{a}^{2}}$.(用含a的式子表示)
(3)在体积为3L的恒容密闭容器中,合成氨N2+3H2?2NH3实验,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2(填“>”、“<”或“=”)
②在T2下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.
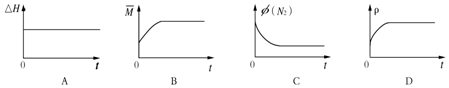
3.一定温度下CO(g)+H2O(g)?CO2(g)+H2(g),将CO和水蒸气各1mol放在密闭容器中反应达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为( )
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
13.氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
| A. | 都能产生丁达尔效应 | |
| B. | 有相同的颜色 | |
| C. | 分散质颗粒直径都在1-100nm之间 | |
| D. | 加入浓氢氧化钠溶液都产生红褐色沉淀 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,22.4 L CCl4、CO2含有的分子数为NA | |
| B. | 通常状况下,NA个CO2分子占有的体积约为22.4 L | |
| C. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |





 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: