题目内容
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)④、⑤的简单离子,其半径更大的是 (写离子符号).
(2)⑦,⑧的气态氢化物,更稳定的是 (填化学式)
(3)①-⑨的最高价氧化物的水化物中:酸性最强的是 (填化学式);碱性最强的是 (填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为 .
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)⑦,⑧的气态氢化物,更稳定的是
(3)①-⑨的最高价氧化物的水化物中:酸性最强的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)同周期自左而右元素非金属性增强,其氢化物稳定性增强;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸;上述元素中Na的金属性最强,故氢氧化钠碱性最强,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)同周期自左而右元素非金属性增强,其氢化物稳定性增强;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸;上述元素中Na的金属性最强,故氢氧化钠碱性最强,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水.
解答:
解:由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故答案为:O2-;
(2)同周期自左而右元素非金属性增强,故非金属性Cl>S,非金属性越强,其氢化物稳定性越稳定,故氢化物稳定性:HCl>H2S,故答案为:HCl;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸,化学式为HClO4;上述元素中Na的金属性最强,故氢氧化钠碱性最强,化学式为NaOH,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:HClO4;NaOH;Al(OH)3+OH-=AlO2-+2H2O.
(1)O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故答案为:O2-;
(2)同周期自左而右元素非金属性增强,故非金属性Cl>S,非金属性越强,其氢化物稳定性越稳定,故氢化物稳定性:HCl>H2S,故答案为:HCl;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸,化学式为HClO4;上述元素中Na的金属性最强,故氢氧化钠碱性最强,化学式为NaOH,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:HClO4;NaOH;Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查元素周期表与元素周期律,比较基础,注意掌握微粒半径比较与金属性、非金属性强弱比较.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A、18g水中含有的氢原子数为2NA |
| B、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| C、2mol硝酸镁固体中含有的硝酸根离子数为4NA |
| D、1mol氧中含有的氧原子数为2NA |
下列四个数据都表示合成氨的反应速率,N2+3H2?2NH3,其中代表同一反应速率的是( )
①v(N2)=0.03mol?L-1?min-1 ②v(NH3)=0.09mol?L-1?min-1
③v(H2)=0.045mol?L-1?min-1 ④v(H2)=0.135mol?L-1?min-1.
①v(N2)=0.03mol?L-1?min-1 ②v(NH3)=0.09mol?L-1?min-1
③v(H2)=0.045mol?L-1?min-1 ④v(H2)=0.135mol?L-1?min-1.
| A、①② | B、①③ | C、③④ | D、②④ |
下列各项化学语言表达正确的是( )
A、F的原子结构示意图: | ||
B、NH4Br的电子式: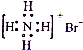 | ||
C、原子核内有l8个中子的氯原子:
| ||
| D、乙烯的结构简式:CH2CH2 |


