题目内容
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键.下列说法不正确的是( )
| A、沸点:W2R>W2Q |
| B、P与R形成化合物中,阴、阳离子个数比一定为1:2 |
| C、原子半径:W<R<Q<P |
| D、Q元素形成的酸一定是强酸 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W的一种核素没有中子应为H元素,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,则R应为O元素,Q为S元素,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键,则P为Na元素,与O可形成Na2O2,既含有离子键又含有非极性共价键,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答:
解:W的一种核素没有中子应为H元素,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,则R应为O元素,Q为S元素,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键,则P为Na元素,与O可形成Na2O2,
A.O非金属性较强,对应的氢化物含有氢键,沸点较高,故A正确;
B.P与R形成化合物为Na2O2或Na2O,阴、阳离子个数比一定为1:2,故B正确;
C.H元素原子半径最小,同周期元素从左到右原子半径逐渐减小,则W(H)<R(O)<Q(S)<P(Na),故C正确;
D.S对应的最高价含氧酸为强酸,但亚硫酸为中强酸,氢硫酸为弱酸,故D错误.
故选D.
A.O非金属性较强,对应的氢化物含有氢键,沸点较高,故A正确;
B.P与R形成化合物为Na2O2或Na2O,阴、阳离子个数比一定为1:2,故B正确;
C.H元素原子半径最小,同周期元素从左到右原子半径逐渐减小,则W(H)<R(O)<Q(S)<P(Na),故C正确;
D.S对应的最高价含氧酸为强酸,但亚硫酸为中强酸,氢硫酸为弱酸,故D错误.
故选D.
点评:本题考查了元素的位置、结构和性质的关系,为高考常见题型,难度不大,能根据题意正确判断元素是解本题的关键,要注意把握对应单质和化合物的性质.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A、标准状况下,33.6L CO2中含有氧原子数为3NA |
| B、1 mol OH-和1 mol-OH(羟基)所含质子数均为9NA |
| C、常温下,100mL 0.1mol?L-1醋酸钠溶液中含醋酸根的数目小于0.01NA |
| D、50mL 18.4mol?L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA |
已知:HCN(aq)+NaOH(aq)═NaCN(aq)+H2O(l)△H=-12.1kJ?mol-1;
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-55.6kJ?mol-1
则HCN在水溶液中电离的△H等于( )
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-55.6kJ?mol-1
则HCN在水溶液中电离的△H等于( )
| A、+43.5 kJ?mol-1 |
| B、+67.7 kJ?mol-1 |
| C、-43.5 kJ?mol-1 |
| D、-67.7 kJ?mol-1 |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
| B、2 g氢气所含原子数目为NA |
| C、在常温常压下,11.2 L氮气所含的原子数目为NA |
| D、17 g氨气所含电子数目为10 NA |
下列图示与对应的叙述相符的是( )
A、 如图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
B、 表示将0.01mol?L-1 NaOH溶液滴人到稀盐酸中的滴定曲线 |
C、 为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法 |
D、 图中曲线表示将pH相同的NH4Cl溶液和盐酸稀释相同倍数时,二者pH的变化 |
NA表示阿佛加德罗常数,下列说法正确的是( )
| A、60克SiO2含有2NA个Si-O共价键 |
| B、1.0L 1.0mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
| A、硫酸,纯碱(Na2CO3),石灰石 |
| B、醋酸,烧碱(Na OH),硫酸铜 |
| C、硝酸,熟石灰,苛性钾(KOH) |
| D、醋酸,小苏打(NaHCO3),熟石灰(Ca(OH)2) |
在水中存在H2O?H++OH-平衡,加入下列哪种物质或进行哪项操作,不会使平衡发生移动( )
| A、加入NaOH固体 |
| B、加入NaCl固体 |
| C、加入CH3COOH固体 |
| D、升温 |
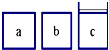 如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问:
如图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2+O2?2SO3的反应.问: