题目内容
14.下列实验操作说法正确的是( )| 选项 | 实验操作 | 现象与结论(或装置用途) |
| A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
| B | 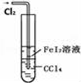 | 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
| C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
| D | 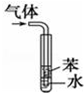 | 用于吸收HCl气体能防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气不是碱,一水合氨是碱;
B.氯气先和碘离子反应生成碘,碘易溶于四氯化碳而使四氯化碳呈紫色,后和亚铁离子反应生成铁离子,铁离子易溶于水中;
C.醛基和新制氢氧化铜悬浊液必须在碱性、加热条件下反应;
D.有缓冲作用的装置能防止倒吸.
解答 解:A.氨气不能电离出氢氧根离子,所以不是碱,一水合氨电离出的阴离子全部是氢氧根离子,所以一水合氨是碱,故A错误;
B.氯气先和碘离子反应生成碘,碘易溶于四氯化碳而使四氯化碳呈紫色,后和亚铁离子反应生成铁离子,铁离子易溶于水中,铁离子呈黄色,所以可以根据哪层液体先变色确定离子反应先后顺序,从而判断氧化性强弱,故B正确;
C.醛基和新制氢氧化铜悬浊液必须在碱性、加热条件下反应,该实验中NaOH不足量,所以不能实现实验目的,故C错误;
D.有缓冲作用的装置能防止倒吸,HCl极易溶于水,不溶于苯,所以没有缓冲作用,不能防止倒吸,可以将苯换为四氯化碳,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及实验操作、氧化性强弱比较、酸碱判断等知识点,明确实验原理、实验基本操作、物质性质是解本题关键,侧重考查学生操作、评价能力,易错选项是C.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列反应过程中断键和成键能量变化符合下图所示的是( )
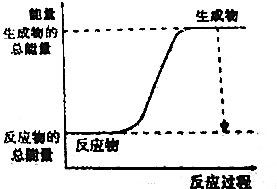

| A. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
2.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性PH3<H2S<H2O (写氢化物的化学式);
(3)元素⑦的原子结构示意图是 ;
;
(4)写出实验室制取③的氢化物的化学反应方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)用电子式表示①与⑨反应得到的化合物的形成过程 .
.
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性PH3<H2S<H2O (写氢化物的化学式);
(3)元素⑦的原子结构示意图是
 ;
;(4)写出实验室制取③的氢化物的化学反应方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)用电子式表示①与⑨反应得到的化合物的形成过程
 .
.
9.下列物质中,属于离子化合物的是( )
| A. | H2SO4 | B. | KOH | C. | O2 | D. | H2O |
19.已知碳酸钙的分解①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发;氯酸钾的分解②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
| A. | △H1=-178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| B. | △H1=178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=78.3kJ•mol-1 | |
| D. | △H1=178.32kJ•mol-1△H2=78.3kJ•mol-1 |

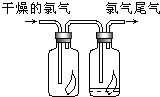 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色