题目内容
下列物质中,只含有极性共价键的是( )
| A、CaCl2 |
| B、KOH |
| C、H2 |
| D、H2O |
考点:极性键和非极性键
专题:
分析:一般来说,活泼金属与非金属形成离子键,不同非金属元素之间形成极性共价键,以此来解答.
解答:
解:A.CaCl2中只含离子键,故A不选;
B.KOH中含有O-H极性键和离子键,故B不选;
C.H2中只含H-H非极性共价键,故C不选;
D.水中只含H-O极性共价键,故D选;
故选D.
B.KOH中含有O-H极性键和离子键,故B不选;
C.H2中只含H-H非极性共价键,故C不选;
D.水中只含H-O极性共价键,故D选;
故选D.
点评:本题考查化学键,把握化学键形成的一般规律为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到4mol Fe(OH)3沉淀,此间共消耗水的物质的量为( )
| A、8 mol |
| B、10 mol |
| C、11 mol |
| D、12 mol |
下列关于反应热的表述正确的是( )
| A、当△H为“-”时,表示该反应为放热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3 |
已知氧化性从强到弱的顺序是:Cl2>Br2>Fe2+>I2,则下列化学方程式(或离子方程式)中错误的是( )
| A、Cl2+2FeCl2→2FeCl3 |
| B、Br2+2Fe2+→2Fe3++2Br- |
| C、2FeCl3+2KI→2FeCl2+2KCl+I2 |
| D、I2+2Fe2+→2I-+2Fe3+ |
下列说法正确的是( )
| A、离子化合物中一定含有离子键 |
| B、含有共价键的化合物一定是共价化合物 |
| C、强电解质与弱电解质的划分标准是电解质在水溶液中导电能力的强弱 |
| D、氧气中氧元素的化合价为0,所以氧分子中没有化学键 |
下列离子方程式表达正确的是( )
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
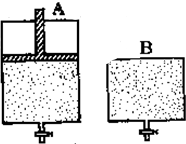 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).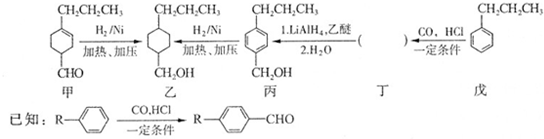
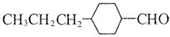 和
和