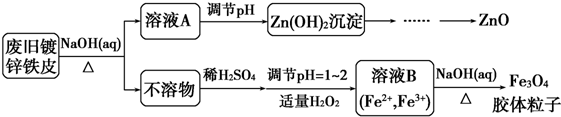
题目内容
16.下列离子方程式书写正确的是( )| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3?+2H2O+CO32- | |
| B. | FeCl3溶液与HI溶液反应:2Fe3++2HI═2Fe2++I2+2H+ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.氢氧化钡过量反应生成碳酸钡、氢氧化钠和水;
B.反应实质三价铁离子与碘离子反应生成二价铁离子和碘;
C.硫化银溶解度小于氯化银,实现沉淀的转化;
D.醋酸为弱酸,应保留化学式.
解答 解:A.NaHCO3溶液中加入过量的Ba(OH)2溶液,离子方程式:HCO3-+Ba2++OH-═BaCO3?+H2O,故A错误;
B.FeCl3溶液与HI溶液反应,离子方程式:2Fe3++2I-═2Fe2++I2,故B错误;
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,离子方程式:2AgCl+S2-═Ag2S↓+2Cl-,故C正确;
D.石灰石与醋酸反应,离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+CH3COO-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,注意化学式的拆分,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列说法正确的是( )
| A. | 滴定管和锥形瓶在使用前要用润洗 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
4.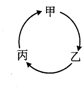 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
( )
 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是| 选项、物质 | 甲 | 乙 | 丙 |
| A | SO2 | SO3 | H2SO4 |
| B | NH4Cl | NH3 | NO |
| C | Na | NaOH | NaCl |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
1.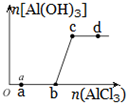 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
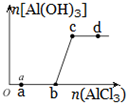 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )| A. | a点对应的溶液中加入MgCl2无明显现象 | |
| B. | b点对应的溶液是NaAlO2溶液 | |
| C. | c点对应的溶液中c(Na+)=c(Cl-) | |
| D. | d点对应的溶液呈酸性 |
8.用两根铂丝做电极插入KOH溶液中,再向两个电极上分别通甲烷气和氧气可形成原电池--燃料电池,根据两极反应的实质判断,通甲烷气的一极电极反应式为:CH4+100H--8e-=CO32-+7H2O,通氧气的一极,在下列叙述中正确的是( )
| A. | 阴极:4H2O+2O2-8e-═8OH- | B. | 正极:4H2O+2O2+8e-═8OH- | ||
| C. | 阴极:4OH-+4e-═2H2O+O2↑ | D. | 正极:4OH--4e-═2H2O+O2↑ |
6.在NH4Cl溶液中,下列关系式正确的是( )
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(Cl-)=c(NH4+)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c (H+)>c(OH-) |