题目内容
6.下列说法正确的是( )| A. | 滴定管和锥形瓶在使用前要用润洗 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
分析 A.中和滴定实验中滴定管需润洗,锥形瓶水洗后,无需润洗;
B.Fe2O3不溶于水,且和水不反应;
C.上层液体从上口倒出;
D.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-;碳酸、亚硫酸酸性弱于盐酸,二氧化碳、二氧化硫和氯化钡都不反应.
解答 解:A.中和滴定实验中用到的滴定管要用将盛装的溶液润洗,而锥形瓶水洗后,无需润洗,若任洗,待测液的物质的量偏大,造成消耗的V(标准)偏大,会使测定结果偏大,故A错误;
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液,故B错误;
C.苯的密度比水小,位于上层,上层液体从上口倒出,用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出,故C正确;
D.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-,生成的沉淀为BaSO4,盐酸是强酸,碳酸、亚硫酸是弱酸,所以碳酸、亚硫酸都不能制取盐酸,即BaCl2溶液与CO2和SO2混合气体不反应,最终没有沉淀析出,故D错误;
故选C.
点评 本题考查实验基本操作,明确基本实验操作原理是解本题关键,注意酸性条件下NO3-与SO2发生氧化还原反应生成SO42-,为易错点.

练习册系列答案
相关题目
10. 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中阴阳离子的个数比都是1:2 |
1.下列反应不属于氧化还原反应的是( )
| A. | 2H2O2═2H2O+O2↑ | B. | HCl+NaOH═H2O+NaCl | ||
| C. | Fe+CuCl2═FeCl2+Cu | D. | 2Cu+O2═2CuO |
11.在胶片冲洗时可用硫代硫酸钠(Na2S2O3)做定影液,与胶片上未曝光的AgBr反应生成可溶性离子Ag(S2O3)23-.该有关过程的离子方程式不合理的是( )
| A. | H2S2O3溶液显弱酸性的原因是:H2S2O3?H++HS2O3- | |
| B. | Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O?H2S2O3+2OH- | |
| C. | Na2S2O3和AgBr反应的离子方程式是:2S2O32-+AgBr?Ag(S2O3)23-+Br- | |
| D. | 定影不能在酸性较强的溶液中进行的原因是:S2O32-+2H+=S↓+SO2↑+H2O |
18.从柑橘中可提炼出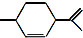 下列关于它的说法不正确的是( )
下列关于它的说法不正确的是( )
 下列关于它的说法不正确的是( )
下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 常温下呈液态,难溶于水 |
15.根据如表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | E2-与B3+的核外电子数不可能相等 | |
| B. | 离子半径大小A+<E2- | |
| C. | 最高价氧化物对应水化物的碱性A<C | |
| D. | 氢化物的稳定性H2D>H2E |
16.下列离子方程式书写正确的是( )
| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3?+2H2O+CO32- | |
| B. | FeCl3溶液与HI溶液反应:2Fe3++2HI═2Fe2++I2+2H+ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.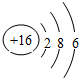 .
.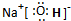 ,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.
,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.