题目内容
5.某有机化合物结构简式为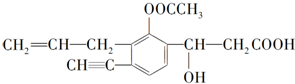
(1)写出其分子式C16H16O5.
(2)写出该分子中含氧官能团的名称羟基、羧基、酯基.
(3)分子中一定与苯环处于同一平面的碳原子数有4个.分子中有2种双键.
分析 由结构可知分子式,分子中含碳碳双键、碳碳三键、-COOC-、-OH、-COOH,结合烯烃、炔烃、酯、醇、羧酸的性质及苯环的平面形结构特点解答该题.
解答 解:(1)由图可知,分子中含16个C、16个H、5个O,则分子式为C16H16O5;
故答案为:C16H16O5;
(2)有机化合物含有的含氧官能团有羟基、羧基、酯基;
故答案为:羟基、羧基、酯基;
(3)不同非金属元素之间形成极性键,则极性键有C=O 外,还有C-H、C-O、O-H,故答案为:C-H、C-O、O-H;
(4)苯环为平面结构、三键为直线结构,双键为平面结构,则与苯环直接相连的C一定与苯环共面,则分子中一定与苯环处于同一平面的碳原子数有4个,分子中含有C=C、C=O两种双键;
故答案为:4;2.
点评 本题考查有机物组成与结构,侧重于学生的分析能力的考查,注意把握甲烷、乙烯、乙炔和苯的结构特点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16. 某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
 某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )| A. | 放电时,外电路的电子由a极移向b极 | |
| B. | 放电时,溶液中H+从左槽移向右槽 | |
| C. | 充电时,a极的反应式为VO2+-e-+H2O=VO2++2H+ | |
| D. | 当左槽溶液颜色由蓝色变为黄色时,电池中能量转化形式为化学能转化为电能 |
20.当光束通过下列分散系时,不可能产生丁达尔效应的是( )
| A. | 墨水 | B. | Fe(OH)3胶体 | C. | CuSO4溶液 | D. | 稀豆浆 |
10.现有下列四个转化,其中不可能通过一步反应实现的是( )
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2.
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
17.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | 一定条件下,W单质可以将Z从其氢化物中置换出来 | |
| D. | 常温下,Z单质与W的常见单质直接生成2W2 |
14.氧化钙在2973K时熔化,而NaCl在1074K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( )
| A. | 氧化钙晶体中阴、阳离子所带电荷数多 | |
| B. | 氧化钙晶格能比氯化钠的晶格能大 | |
| C. | 两种晶体的晶胞结构类型不同 | |
| D. | 氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定 |
15.已知33As、35Br位于同一周期,下列关系正确的是( )
| A. | 原子半径:As>Cl>Br | B. | 热稳定性:HCl>AsH3>HBr | ||
| C. | 还原性:As3->S2->Cl- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
 生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中含氧量较多,燃烧过程电会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.
生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中含氧量较多,燃烧过程电会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀. .
.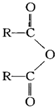 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
 ,CH2=C(CH3)CH=CH2.
,CH2=C(CH3)CH=CH2.