题目内容
12.在相同条件下,把镁、铝、铁三种金属分别放入质量相等且足量的盐酸中,待反应完全后,三种溶液的质量相等,则投入的镁、铝、铁三种金属的质量关系是( )| A. | Al>Mg>Fe | B. | Al=Mg=Fe | C. | Fe>Mg>Al | D. | Mg>Al>Fe |
分析 将Mg、Al、Fe三种金属分别投入质量相等且足量的稀硫酸中,反应结束后溶液的质量仍相等,说明溶液质量增加的质量相等,即加入的金属质量减去生成的氢气的质量相等,结合关系式计算.
解答 解:将Mg、Al、Fe三种金属分别投入质量相等且足量的稀硫酸中,反应结束后溶液的质量仍相等,说明溶液质量增加的质量相等,即加入的金属质量减去生成的氢气的质量相等,
设镁的质量为xg,铝的质量为yg,铁的质量为zg,则:
Mg~H2↑
24 2
xg $\frac{1}{12}$xg
2Al~3H2↑
54 6
yg $\frac{1}{9}$y g
Fe~H2↑
56 2
zg $\frac{1}{28}$zg
则xg-$\frac{1}{12}$xg=yg-$\frac{1}{9}$y g=zg-$\frac{1}{28}$zg
即:$\frac{11x}{12}$g=$\frac{8y}{9}$g=$\frac{27}{28}$g,故z<x<y,
所以投入的镁、铝、铁三种金属的质量关系为:Fe>Mg>Al,
故选C.
点评 本题考查混合物反应的计算,题目难度不大,明确加入金属与生成的氢气质量之差相等是解题关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
2.标准状态下,现在一固定容积的容器盛满NO、O2、NO2混合气体,将该容器倒置在水中,充分反应后无剩余气体,所得溶液的物质的量为m mol/L则m( )
| A. | $\frac{1}{39.2}$<m<$\frac{1}{28}$ | B. | $\frac{1}{39.2}$<m<33.6 | C. | 0<m<$\frac{1}{22.4}$ | D. | $\frac{1}{28}$<$\frac{1}{22.4}$ |
3.下列关于${\;}_{2}^{3}$He的说法正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内含有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核内含有2个质子 | |
| C. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的元素 |
7.已知铝也能和氢氧化钠溶液反应:2Al+2NaOH+2H2O→2NaAlO2+3H2↑,现有两份铝,一份与过量的氢氧化钠溶液反应,另一份与过量的盐酸反应,若要制取等质量的氢气,则两份铝的质量比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
4.对一些具有危险的化学物质,若要在其包装上贴危险化学品标记,下列标签贴错的是( )
| A. |  浓硫酸 | B. |  汽油 | C. |  KNO3 | D. |  乙醇 |
2.已知: ,
, 叫狄尔斯阿德而反应,用于构建六元环状烃,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用于构建六元环状烃,则下列说法不正确的是( )
 ,
, 叫狄尔斯阿德而反应,用于构建六元环状烃,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用于构建六元环状烃,则下列说法不正确的是( )| A. | 上述信息中反应的产物都可以使酸性高锰酸钾溶液褪色 | |
| B. | 通过上述反应合成 ,所需反应物为 2-甲基-1,3-丁二烯和乙烯 ,所需反应物为 2-甲基-1,3-丁二烯和乙烯 | |
| C. | 2-甲基-1,3-丁二烯和丙烯发生上述反应产物只有一种 | |
| D. | 2mol 环戊二烯发生上述反应的方程式为: |
 A、B、C、D均为含苯环的有机物,且式量B>A>C.
A、B、C、D均为含苯环的有机物,且式量B>A>C. .
. .
. 、
、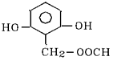 、
、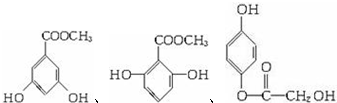 (其中的任意2种).
(其中的任意2种).