题目内容
3.下列关于${\;}_{2}^{3}$He的说法正确的是( )| A. | ${\;}_{2}^{3}$He原子核内含有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核内含有2个质子 | |
| C. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的元素 |
分析 A.原子中质量数=质子数+中子数;
B.元素符号左下角为质子数;
C.原子中核电荷数=质子数=核外电子数;
D.具有质子数相同的同种元素的同一类原子总称为元素.
解答 解:A.原子中质量数=质子数+中子数,${\;}_{2}^{3}$He原子核内含有中子数=3-2=1,故A错误;
B.元素符号左下角为质子数为2,故B正确;
C.原子中核电荷数=质子数=核外电子数,${\;}_{2}^{3}$He原子核外有2个电子,故C错误;
D.具有质子数相同的同种元素的同一类原子总称为元素,${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同原子,属于同种元素的不同原子为元素的同位素,故D错误;
故选B.
点评 本题考查了原子结构、微粒的定量关系分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
7.下列有关物质分类的正确组合是( )
| 分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | CaF2 | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A. | A | B. | B | C. | C | D. | D |
14.某学生设计如图实验步骤测定铁铜合金的组成: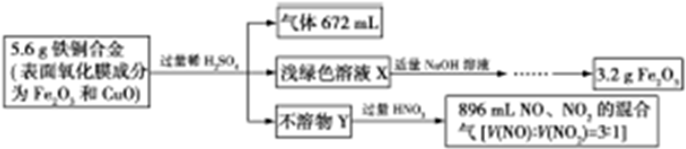
说明:以上所有气体体积都已换算成标准状况时的数据
下列说法正确的是( )

说明:以上所有气体体积都已换算成标准状况时的数据
下列说法正确的是( )
| A. | 不溶物Y为Cu且质量是1.6g | |
| B. | 合金中铁单质的质量是1.68g | |
| C. | 合金中氧元素的物质的量是0.01mol | |
| D. | X溶液中既含有CuSO4又含有FeSO4 |
11.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定含NH4+ | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 将某气体通入品红溶液中,红色褪去,该气体一定是SO2 | |
| D. | 向某溶液中加入盐酸酸化的BaCl2溶液有白色沉淀,该溶液中一定含有SO42- |
18.下列离子方程式正确的是( )
| A. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | FeBr2溶液中加入过量的氯水:2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D. | 铝和烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
15.现有溴苯、乙醇、甲苯、己烯四种液体,只用一种试剂就可以将它们区别开,这种试剂是( )
| A. | 溴水 | B. | 食盐水 | C. | NaOH溶液 | D. | 盐酸 |
12.在相同条件下,把镁、铝、铁三种金属分别放入质量相等且足量的盐酸中,待反应完全后,三种溶液的质量相等,则投入的镁、铝、铁三种金属的质量关系是( )
| A. | Al>Mg>Fe | B. | Al=Mg=Fe | C. | Fe>Mg>Al | D. | Mg>Al>Fe |


 某研究性学习小组对教材中的铁与高温水蒸气反应的实验装置图做了如图所示的优化.通过观察硬质玻璃管Ⅱ和干燥管Ⅱ中的现象证明铁与水蒸气发生了反应,用试管收集产生的经干燥的气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组对教材中的铁与高温水蒸气反应的实验装置图做了如图所示的优化.通过观察硬质玻璃管Ⅱ和干燥管Ⅱ中的现象证明铁与水蒸气发生了反应,用试管收集产生的经干燥的气体,并靠近火焰点火,观察现象.请回答下列问题: