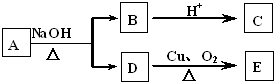
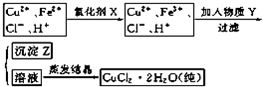
题目内容
工业上制取纯净的CuCl2?2H2O的主要过程是:①将粗氧化铜(含少量Fe)溶解于稀盐酸中,加热,调节滤液的PH为3;②对①所得滤液按下列步骤进行操作:

已知Cu2+、Fe2+在PH为4~5时不水解,而Fe3+却几乎完全水解而沉淀.请回答下列问题:
(1)X是(填化学式) ,其反应的离子方程式为 ;
(2)Y可选择下列物质中的(填编号)
①Cu ②CuO固体 ③Cu(OH)2固体 ④NaOH固体
(3)溶液乙在蒸发结晶时应注意 .
(4)向盛有1mL 0.1mol/L CuCl2溶液的试管中滴加2滴(1滴约0.05mL)2mol/L NaOH溶液,有蓝色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置.可以观察到的现象是 ,产生该现象的原因是 .

已知Cu2+、Fe2+在PH为4~5时不水解,而Fe3+却几乎完全水解而沉淀.请回答下列问题:
(1)X是(填化学式)
(2)Y可选择下列物质中的(填编号)
①Cu ②CuO固体 ③Cu(OH)2固体 ④NaOH固体
(3)溶液乙在蒸发结晶时应注意
(4)向盛有1mL 0.1mol/L CuCl2溶液的试管中滴加2滴(1滴约0.05mL)2mol/L NaOH溶液,有蓝色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置.可以观察到的现象是
考点:物质分离和提纯的方法和基本操作综合应用,性质实验方案的设计
专题:实验设计题
分析:①的滤液中含有亚铁离子、铜离子、氯离子,加入氧化剂将亚铁离子氧化成铁离子,然后加入Y调节溶液的pH,将铁离子转化成氢氧化铁沉淀除去,得到的溶液乙为氯化铜溶液,然后在持续通入HCl气体并不断搅拌条件下蒸发溶液乙获得氯化铜晶体,
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,据此判断X;双氧水与亚铁离子发生氧化还原反应生成 铁离子和水;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子;
(3)根据制备流程可知,溶液乙为氯化铜溶液,氯化铜水溶液蒸发浓缩,铜离子水解,所以在对溶液乙蒸发结晶时需要在氯化氢气流中蒸发析出晶体;
(4)Fe(OH)3比Cu(OH)2更难溶,沉淀向着更难溶的物质转化.
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,据此判断X;双氧水与亚铁离子发生氧化还原反应生成 铁离子和水;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子;
(3)根据制备流程可知,溶液乙为氯化铜溶液,氯化铜水溶液蒸发浓缩,铜离子水解,所以在对溶液乙蒸发结晶时需要在氯化氢气流中蒸发析出晶体;
(4)Fe(OH)3比Cu(OH)2更难溶,沉淀向着更难溶的物质转化.
解答:
解:根据题中信息可知,①的滤液中含有亚铁离子、铜离子、氯离子,加入氧化剂将亚铁离子氧化成铁离子,然后加入Y调节溶液的pH,将铁离子转化成氢氧化铁沉淀除去,得到的溶液乙为氯化铜溶液,然后在持续通入HCl气体并不断搅拌条件下蒸发溶液乙获得氯化铜晶体,
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,过氧化氢具有强氧化性,且反应后生成水,则过氧化氢为最佳试剂;过氧化氢与亚铁离子反应的离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:H2O2; H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子,实验需要加入和酸反应的固体物质,如CuO或Cu(OH)2、CuCO3;铜和氢离子不反应,不能调节pH,氢氧化钠会引进新的杂质离子,则Y物质不能选用氢氧化钠,所以②③正确,
故答案为:②③;
(3)乙溶液为氯化铜溶液,氯化铜水溶液蒸发浓缩,铜离子水解,CuCl2+H2O?Cu(OH)2+2HCl,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,灼烧后得到的固体为CuO,所以实验需要在氯化氢气流中蒸发,抑制水解反应进行,待出现固体时,冷却结晶得到氯化铜晶体,
故答案为:持续通入HCl气体并不断搅拌,且溶液不能蒸干;
(4)氯化铜容液会和氢氧化钠反应生成氢氧化铜蓝色沉淀,Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),滴入的FeCl3溶液电离的Fe3+与溶解平衡产生的OH-反应生成溶度积更小(或更难溶)的Fe(OH)3,所以蓝色沉淀转化为红褐色的沉淀,由于Fe(OH)3比Cu(OH)2更难溶,使Cu(OH)2的溶解平衡继续向右移动,直至Cu(OH)2全部转化为Fe(OH)3沉淀,
故答案为:蓝色沉淀转变为红褐色沉淀;因为开始生成的蓝色沉淀Cu(OH)2存在溶解平衡Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),滴入的FeCl3溶液电离的Fe3+与溶解平衡产生的OH-反应生成溶度积更小(或更难溶)的Fe(OH)3,使Cu(OH)2的溶解平衡继续向右移动,直至Cu(OH)2全部转化为Fe(OH)3沉淀.
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,过氧化氢具有强氧化性,且反应后生成水,则过氧化氢为最佳试剂;过氧化氢与亚铁离子反应的离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:H2O2; H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子,实验需要加入和酸反应的固体物质,如CuO或Cu(OH)2、CuCO3;铜和氢离子不反应,不能调节pH,氢氧化钠会引进新的杂质离子,则Y物质不能选用氢氧化钠,所以②③正确,
故答案为:②③;
(3)乙溶液为氯化铜溶液,氯化铜水溶液蒸发浓缩,铜离子水解,CuCl2+H2O?Cu(OH)2+2HCl,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,灼烧后得到的固体为CuO,所以实验需要在氯化氢气流中蒸发,抑制水解反应进行,待出现固体时,冷却结晶得到氯化铜晶体,
故答案为:持续通入HCl气体并不断搅拌,且溶液不能蒸干;
(4)氯化铜容液会和氢氧化钠反应生成氢氧化铜蓝色沉淀,Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),滴入的FeCl3溶液电离的Fe3+与溶解平衡产生的OH-反应生成溶度积更小(或更难溶)的Fe(OH)3,所以蓝色沉淀转化为红褐色的沉淀,由于Fe(OH)3比Cu(OH)2更难溶,使Cu(OH)2的溶解平衡继续向右移动,直至Cu(OH)2全部转化为Fe(OH)3沉淀,
故答案为:蓝色沉淀转变为红褐色沉淀;因为开始生成的蓝色沉淀Cu(OH)2存在溶解平衡Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),滴入的FeCl3溶液电离的Fe3+与溶解平衡产生的OH-反应生成溶度积更小(或更难溶)的Fe(OH)3,使Cu(OH)2的溶解平衡继续向右移动,直至Cu(OH)2全部转化为Fe(OH)3沉淀.
点评:本题考查了物质制备实验方案的设计、物质的分离与提纯方法综合应用,题目难度中等,明确制备流程及反应原理为解答关键,需要注意除杂不能引入新的杂质,试题侧重考查学生的分析、理解能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、将标准状况下336 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| C、次氯酸钙溶液中通入过量二氧化硫:Ca(ClO)2+H2O+SO2=CaSO3↓+2HClO |
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
NA表示阿伏伽德罗常数,下列判断正确的是( )
| A、在20gD216O中含有10NA个电子 |
| B、标准情况下,2.24L己烷所含分子数为0.1NA |
| C、1molCl2参加反应时转移电子数一定为2NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
下列粒子在化学反应中既能表现氧化性又能表现还原性的是( )
| A、S2- |
| B、Al3+ |
| C、H2O2 |
| D、K |
下列萃取和分液结合进行的操作(用煤油为萃取剂从碘水中萃取碘)中,错误的是( )
| A、饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,且一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来用力振荡 |
| B、静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通,以准备放出液体 |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 |
| D、上层液体在分液漏斗中保存 |