题目内容
不同金属离子在溶液中完全沉淀时,溶液的pH不同.
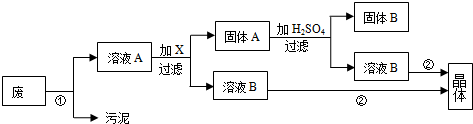
氯化铜晶体(CuCl2?2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯.
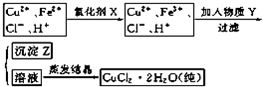
(1)下列氧化剂中最适合作氧化剂X的是 (填序号);
A.NaClO B.H2O2 C.KMnO4 D.HNO3
(2)物质Y的化学式是 ;
(3)写出沉淀Z在水中的沉淀溶解平衡方程式 :.
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |

(1)下列氧化剂中最适合作氧化剂X的是
A.NaClO B.H2O2 C.KMnO4 D.HNO3
(2)物质Y的化学式是
(3)写出沉淀Z在水中的沉淀溶解平衡方程式
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质,双氧水是绿色氧化剂;
(2)试剂是调节pH至4~5,使Fe3+全部沉淀,同样不引进新杂质,据此来选择合适的物质;
(3)难溶物Z为Fe(OH)3,在水中存在沉淀溶解平衡.
(2)试剂是调节pH至4~5,使Fe3+全部沉淀,同样不引进新杂质,据此来选择合适的物质;
(3)难溶物Z为Fe(OH)3,在水中存在沉淀溶解平衡.
解答:
解:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,发生的反应为:2Fe2++H2O2+2H+2Fe3++2H2O,A会引入杂质钠离子,C会引入K+、Mn2+,I2氧化性弱不能氧化亚铁离子;
故答案为:B;
(2)分析流程和分离提纯目的可知物质Y是调节溶液PH沉淀铁离子生成Fe(OH)3,且不引入新的杂质,可以加入CuO(或Cu(OH)2、CuCO3);
故答案为:CuO(或Cu(OH)2、CuCO3);
③难溶物Z为Fe(OH)3 ,在水中的沉淀溶解平衡方程式为:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq);
故答案为:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq).
故答案为:B;
(2)分析流程和分离提纯目的可知物质Y是调节溶液PH沉淀铁离子生成Fe(OH)3,且不引入新的杂质,可以加入CuO(或Cu(OH)2、CuCO3);
故答案为:CuO(或Cu(OH)2、CuCO3);
③难溶物Z为Fe(OH)3 ,在水中的沉淀溶解平衡方程式为:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq);
故答案为:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq).
点评:本题考查了物质分离方法和实验高层次分析判断,除杂原则是不能引入新的杂质,题目难度中等.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目