题目内容
4.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等:(1)下列能说明碳、硫两种元素非金属性相对强弱的是③(填序号)、
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似.羰基硫(COS)的电子式为
 .
.
分析 (1)a.相同条件下水溶液的pH:Na2CO3>Na2SO4,说明碳酸氢根离子的酸性比硫酸弱;
b.非金属强弱与最高价氧化物对应水化物的酸性强弱有关;
c.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C;
(2)根据羰基硫分子中所有原子的最外层都满足8电子结构判断其电子式.
解答 解:(1)a.相同条件下水溶液的pH:Na2CO3>Na2SO4,说明碳酸氢根离子的酸性比硫酸弱,故不选;
b.非金属强弱与最高价氧化物对应水化物的酸性强弱有关,而亚硫酸中的硫是+4价,故不选;
c.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故选;故答案为:③;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为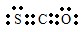 ,
,
故答案为: .
.
点评 本题考查了物质结构元素周期律,综合性较强,掌握同一周期元素性质递变规律,明确元素最高价氧化物的水化物酸碱性是解本题②的关键,题目难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
14. 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
(1)“氯氧化法”是指在碱性条件下用将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O
(2)地康法制备氯气的反应为 4HCl(g)+O2(g)$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1,1 mol H-Cl、l mol Cl-Cl、1 mol O=O断裂时分别需要吸收 431 KJ、243 kJ、489 kJ 的能量,则 1 mol O一H断裂时需吸收的能量为463.4kJ
(3)取ClO2消毒过的自来水(假定ClO2全部转化为Cl-)30.00 mL在水样中加人几滴K2CrO4),溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4,沉淀出现时,反应达到滴定终点.测得溶液
中CrO42-的浓度是5.00×10-3 mol•L-1,则滴定终点时溶液中c(Cl-)=8.90×10-6mol/L.[已知:
KSP(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12]
(4)在5个恒温、恒容密闭容器中分别充入4 mol ClO2,发生反应4ClO2(g)?2Cl2O(g)+3O2(g)△H>0,测得ClO2(g)的部分平衡转化率如表所示.
已知:T3>T2,V2>V1
①该反应中Cl2O是还原产物(填“还原产物”或“氧化产物”).
②T1℃时,上述反应的平衡常数K25.63
③V2>(填“>”“<”或“=”)V3
④d、e两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示.a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为e<a=d(用字母表示);与a容器相比,d容器中改变的一个实验条件是加入催化剂,其判断依据是ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变.
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:(1)“氯氧化法”是指在碱性条件下用将废水中的CN-氧化成无毒物质.写出该反应的离子方程式:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O
(2)地康法制备氯气的反应为 4HCl(g)+O2(g)$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1,1 mol H-Cl、l mol Cl-Cl、1 mol O=O断裂时分别需要吸收 431 KJ、243 kJ、489 kJ 的能量,则 1 mol O一H断裂时需吸收的能量为463.4kJ
(3)取ClO2消毒过的自来水(假定ClO2全部转化为Cl-)30.00 mL在水样中加人几滴K2CrO4),溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4,沉淀出现时,反应达到滴定终点.测得溶液
中CrO42-的浓度是5.00×10-3 mol•L-1,则滴定终点时溶液中c(Cl-)=8.90×10-6mol/L.[已知:
KSP(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12]
(4)在5个恒温、恒容密闭容器中分别充入4 mol ClO2,发生反应4ClO2(g)?2Cl2O(g)+3O2(g)△H>0,测得ClO2(g)的部分平衡转化率如表所示.
| 容器编号 | 温度/℃ | 容器体积/L | Cl02(g)的平衡转化率 |
| a | T1 | V1=l L | 75% |
| b | T1 | v2 | |
| c | T3 | v3 | 75% |
| d | |||
| e |
①该反应中Cl2O是还原产物(填“还原产物”或“氧化产物”).
②T1℃时,上述反应的平衡常数K25.63
③V2>(填“>”“<”或“=”)V3
④d、e两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示.a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为e<a=d(用字母表示);与a容器相比,d容器中改变的一个实验条件是加入催化剂,其判断依据是ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变.
12.(1)砷原子核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)H2S和H2O2的主要物理性质比较如表:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子之间会形成氢键,所以熔沸点高,H2O2与水分子之间会形成氢键,所以溶解度大.
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力.
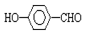 的沸点比
的沸点比 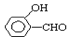 高,原因是:
高,原因是: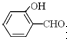 形成分子内氢键,而
形成分子内氢键,而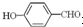 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.
(5)H+可与H2O形成H3O+,H3O+中O原子采用sp3杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaO晶胞体积为$\frac{224}{a{N}_{A}}$cm3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)H2S和H2O2的主要物理性质比较如表:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力.
 的沸点比
的沸点比  高,原因是:
高,原因是: 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.(5)H+可与H2O形成H3O+,H3O+中O原子采用sp3杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaO晶胞体积为$\frac{224}{a{N}_{A}}$cm3.
19.某无色澄清溶液中Cl-浓度为0.5mol•L-1,还可能含有表中的若干种离子.
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子有OH-、NO3-.能确定一定不存在的离子是Al3+、Mg2+、Ba2+、Fe3+、SO42-
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:存在,由电荷守恒可知最小浓度为3.1mol•L-1.
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)通过以上实验不能确定是否存在的离子有OH-、NO3-.能确定一定不存在的离子是Al3+、Mg2+、Ba2+、Fe3+、SO42-
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
| 阴离子 | 浓度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
| ③ |
9.今有一种固体化合物X,X本身不导电,但熔融状态和溶于水时能够电离,下列关于X的说法中,不正确的是( )
| A. | X一定为电解质 | B. | X可能为NaCl | ||
| C. | X不能是酸类 | D. | X可以是任何化合物 |
16.室温下,将浓度均为0.1mol/L的一元酸HA和NaOH溶液等体积混合,得到混合溶液①,该混合溶液pH=9,下列说法正确的是( )
| A. | 室温下,0.1mol/LHA溶液的pH=1 | B. | 0.1mol/LHA溶液中:c(HA)>c(A-) | ||
| C. | ①溶液中:c(HA)+c(A-)=0.1mol/L | D. | ①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) |
13.下列关于新型有机高分子材料的说法中不正确的是( )
| A. | 高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿酒业等 | |
| B. | 合成高分子材料制成的人工器官一般都受到人体的排斥作用,难以达到生物相容的程度 | |
| C. | 复合材料一般是以一种材料作为基体,另一种材料作为增强剂 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |