题目内容
20.氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.[查阅资料]
氢化钙通常用氢气与钙加热制得.
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热.
标准状况下氢气的密度为0.09g/L.
[进行实验]小组同学设计的制取装置如图所示(固定装置略).
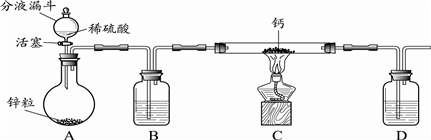
回答下列问题:
(1)写出A中发生反应的化学方程式Zn+H2SO4=ZnSO4+H2↑.
(2)B、D中所盛试剂相同,该试剂为浓硫酸,其作用分别是干燥氢气、防止空气中的水蒸汽进入C中.
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是排除装置内的空气,防止加热时产生爆炸.
(4)装置C中制取氢化钙的化学方程式是H2+Ca $\frac{\underline{\;\;△\;\;}}{\;}$CaH2.
[实验反思]小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).
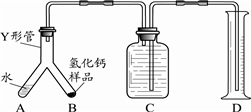
步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
通过上述实验可分析出制得的氢化钙是否纯净,其依据是根据实验得出的氢气的体积,可计算出氢气的质量,再根据氢化钙与水反应的化学方程式,计算出所需氢化钙的质量,并与氢化钙样品质量作对比.
分析 (1)根据实验室用稀硫酸和锌粒反应制取氢气进行解答;
(2)根据信息资料氢气与钙反应必须是干燥的氢气,氢化钙不能与水接触,因此D也是干燥装置;
(3)根据氢气的可燃性分析;
(4)钙和氢气反应在加热的条件下生成氢化钙;
【实验反思】要验证氢化钙是否纯净,可取一定量氢化钙样品与水完全反应,根据生成氢气的质量求出氢化钙的质量,然后与样品质量比较,
解答 解:(1)实验室用稀硫酸和锌粒反应制取氢气,化学方程式Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+H2SO4=ZnSO4+H2↑;
(2)用氢气与钙加热制得氢化钙,因钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热,所以与钙反应的氢气必须是干燥的氢气,故制取的氢气需通过浓硫酸进行干燥,因生成的氢化钙遇水反应生成氢氧化钙和氢气,因此为防止防止空气中的水蒸汽进入C中,需在D中装有浓硫酸进行干燥,
故答案为:浓硫酸;干燥氢气;防止空气中的水蒸汽进入C中;
(3)点燃不纯的氢气可能会发生爆炸,因此氢气与钙加热反应前需将装置内的空气排出,故实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,以排除装置内的空气,防止加热时产生爆炸,
故答案为:排除装置内的空气,防止加热时产生爆炸;
(4)钙和氢气反应在加热的条件下生成氢化钙,反应的方程式为H2+Ca $\frac{\underline{\;\;△\;\;}}{\;}$CaH2,
故答案为:H2+Ca $\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
【实验反思】
根据图示,要验证氢化钙是否纯净,可取一定量氢化钙样品与水完全反应,根据生成氢气的质量求出氢化钙的质量,然后与样品质量比较,
故答案为:根据实验得出的氢气的体积,可计算出氢气的质量,再根据氢化钙与水反应的化学方程式,计算出所需氢化钙的质量,并与氢化钙样品质量作对比.
点评 解答时注意分析题目所给信息并结合所学知识,对信息加以整合,依据题意分析问题、解决问题.

| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |

| A. | a与b比较,b使用了催化剂 | B. | a与b比较,b温度更高 | ||
| C. | a与b比较,b的压强更大 | D. | a与b比较,b反应速率更大 |
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)3~4min,7~9min时段,反应处于平衡状态.
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正方向移动.(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a.260℃Cr2O3 (填Fe203、Ni0或Cr203)作催化剂反应速率最快.Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率.
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b.请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线.
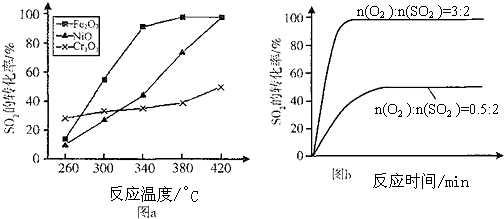
| A. | 某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,不含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.