题目内容
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:
(3)浓硫酸的作用是:①
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)醋酸易挥发,乙醇的密度比浓硫酸的小,类比浓硫酸的稀释进行解答;
(3)浓硫酸起到了催化作用和吸水作用;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(5)根据导管伸入液面下可能发生倒吸分析;
(6)分离互不相溶的液体,可用分液的方法分离;
(7)液体加热要加碎瓷片,防止暴沸.
(2)醋酸易挥发,乙醇的密度比浓硫酸的小,类比浓硫酸的稀释进行解答;
(3)浓硫酸起到了催化作用和吸水作用;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(5)根据导管伸入液面下可能发生倒吸分析;
(6)分离互不相溶的液体,可用分液的方法分离;
(7)液体加热要加碎瓷片,防止暴沸.
解答:
解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:
CH3COOH+CH3CH2OH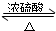 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH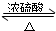 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,
故答案为:在1支大试管中加3ml乙醇,然后边摇动边慢慢加入浓硫酸,最后向加入乙酸;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂;吸水剂;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度;
(5)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:倒吸;
(6)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液;
(7)液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,
故答案为:防止暴沸.
CH3COOH+CH3CH2OH
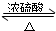 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH
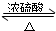 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;(2)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,
故答案为:在1支大试管中加3ml乙醇,然后边摇动边慢慢加入浓硫酸,最后向加入乙酸;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂;吸水剂;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度;
(5)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:倒吸;
(6)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液;
(7)液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,
故答案为:防止暴沸.
点评:本题考查乙酸乙酯的制备,题目难度中等,涉及的题量较大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
把2.0mol/L CuSO4溶液和1.0mol/L H2SO4 溶液等体积混合( 假设混合后溶液的体积等于混合前两种溶液的体积之和),向溶液中加入足量的铁粉,经足够长时间后,铁粉剩余.此时溶液中Fe2+的物质的量浓度( )
| A、1.5mol/L |
| B、2.0mol/L |
| C、1.0mol/L |
| D、3.0mol/L |
对反应A+3B?2C 来说,下列反应速率中,最快的是( )
| A、v(A)=0.3 mol/(L?min) |
| B、v(B)=0.6 mol/(L?min) |
| C、v(C)=0.5 mol/(L?min) |
| D、v(A)=0.1 mol/(L?s) |


 (1)把物质进行分类,是认识物质的组成、结构、性质和用途的便捷途径.请用分类的方法来认识以下物质(填序号):①NaCl晶体 ②金属铜 ③盐酸 ④SO2 ⑤蔗糖 ⑥BaSO4 ⑦纯醋酸
(1)把物质进行分类,是认识物质的组成、结构、性质和用途的便捷途径.请用分类的方法来认识以下物质(填序号):①NaCl晶体 ②金属铜 ③盐酸 ④SO2 ⑤蔗糖 ⑥BaSO4 ⑦纯醋酸