题目内容
9.下列说法中正确的是( )| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子之间的作用力 | |
| C. | 烧碱固体溶于水的过程中,共价键被破坏 | |
| D. | 有机化合物CH3CH2NO2与H2N-CH2-COOH是同分异构体 |
分析 A.根据共价键的定义判断;
B.先判断是否发生化学反应再判断破坏的是化学键还是分子间作用力;
C.氢氧化钠在溶液中电离出钠离子和氢氧根离子;
D.分子式相同结构不同的化合物互称同分异构体.
解答 解:A.HCl分子中氢、氯原子间通过共用电子对形成化学键,是共价键,在其溶液里,在水分子的作用下,能电离出阴阳离子,故A错误;
B.碘晶体受热转变成碘蒸气,共价键没有断裂,克服的不是原子之间的作用力,而是分子间的作用力,故B错误;
C.氢氧化钠在溶液中电离出钠离子和氢氧根离子,所以烧碱固体溶于水的过程中,只破坏离子键,共价键没有被破坏,故C错误;
D.有机化合物CH3CH2NO2与H2N-CH2-COOH分子式相同结构不同,是同分异构体,故D正确.
故选D.
点评 本题考查了化学键、同分异构体等知识点,难度不大,注意把握同分异构体的概念,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
19.只用水不能鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙酸乙酯和乙醇 | C. | 苯和四氯化碳 | D. | 苯和乙酸 |
17.除去FeCl3溶液中混有的少量FeCl2,可以向此溶液中通入过量的氯气,发生如下反应:2FeCl2+Cl2═2FeCl3.对于该反应说法正确的是( )
| A. | 属于氧化还原反应 | B. | 属于复分解反应 | ||
| C. | Cl2作还原剂 | D. | Fe2+被还原 |
4.某能使石蕊试液变红的溶液中,能大量存在的离子是( )
| A. | Fe2+ K+NO3-Cl- | B. | Na+Mg2+ HCO3- NO3- | ||
| C. | K+ Na+ AlO2-Cl- | D. | Al3+ NH4+ SO42-Cl- |
1.下列关于物质“反应程度”的说法正确的是( )
| A. | 一定条件下,2mol SO2与足量O2反应可得到2mol SO3 | |
| B. | 含4mol HCl 的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 | |
| C. | 10ml 18.0 mol/L H2SO4与足量铜加热反应可制备0.09 mol SO2 | |
| D. | 一定条件下,1mol N2与3 mol H2反应可制备1.0 mol NH3 |
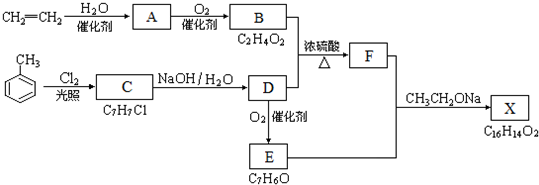
 ;
; ;
;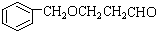 B、
B、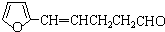
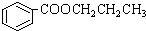
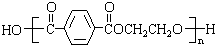 ,其合成单体为
,其合成单体为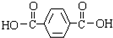 和HOCH2CH2OH;
和HOCH2CH2OH;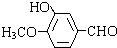 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.