题目内容
13.下列有关物质性质的应用错误的是( )| A. | 硅酸盐可用于制作光导纤维 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 明矾溶于水后会产生Al(OH)3胶体,可作为净水剂 | |
| D. | 液氨挥发时会吸收大量的热,可作为制冷剂 |
分析 A.依据光导纤维主要成分是二氧化硅解答;
B.氯化铁与铜反应生成氯化铜和氯化亚铁;
C.依据盐类水解的性质及应用解答;
D.液氨汽化吸收大量的热.
解答 解:A.光导纤维主要成分是二氧化硅,不是硅酸盐,故A错误;
B.氯化铁与铜反应生成氯化铜和氯化亚铁,所以FeCl3溶液可用于蚀刻印刷电路,故B正确;
C.明矾溶于水后,铝离子水解生成Al(OH)3胶体,氢氧化铝胶体具有吸附性,可以吸附水中固体杂质颗粒,可作为净水剂,故C正确;
D.液氨挥发时会吸收大量的热,可作为制冷剂,故D正确;
故选:A.
点评 本题考查了元素化合物知识,侧重考查元素化合物用途,熟悉二氧化硅、氯化铁、明矾、液氨的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
4.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol铁与足量的氯气完全反应转移的电子数为2NA | |
| B. | 常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA | |
| C. | 标准状况下,1molCO2、CO的混合气中含有的碳原子数为NA | |
| D. | 1L1mol•L-1CuCl2溶液中含有的氯离子数为NA |
8.下列反应不适合用来制取NH3的是( )
| A. | N2和H2在一定条件下合成氨 | |
| B. | 加热NH4Cl使其分解,可以同时获得NH3和HCl | |
| C. | 加热NH4Cl和Ca(OH)2的固体混合物,获得NH3 | |
| D. | 加热浓氨水,促使其分解制得NH3 |
18.单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质).粗硅与氯气反应生成四氯化硅(反应温度450:500℃)四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.
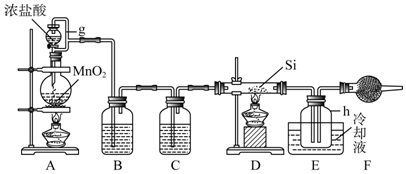
相关信息如下:
a.四氯化硅遇水极易反应;
b.硝、铝、铁、磷在高温下均能与氧气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
请回答下列问题:
(1)写出装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;制备粗硅的化学反应方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)装置B中的试剂是饱和食盐水;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集;干燥管F中碱石灰的作用是吸收空气中的水蒸气.
(3)装置E中h瓶收集到的粗产物含有多种杂质:BCl3、AlCl3、FeCl3、PCl3,根据题给信息,可通过蒸馏(填操作名称),得到高纯度四氯化硅.
(4)从二氧化硅到高纯硅的生产流程中,经历了一系列氧化还原反.涉及多种含硅物质,这些含硅的物质中,作为氧化剂的有SiO2、SiCl4;作为还原剂的有Si.

相关信息如下:
a.四氯化硅遇水极易反应;
b.硝、铝、铁、磷在高温下均能与氧气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl3 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -17.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 163 |
(1)写出装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;制备粗硅的化学反应方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)装置B中的试剂是饱和食盐水;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集;干燥管F中碱石灰的作用是吸收空气中的水蒸气.
(3)装置E中h瓶收集到的粗产物含有多种杂质:BCl3、AlCl3、FeCl3、PCl3,根据题给信息,可通过蒸馏(填操作名称),得到高纯度四氯化硅.
(4)从二氧化硅到高纯硅的生产流程中,经历了一系列氧化还原反.涉及多种含硅物质,这些含硅的物质中,作为氧化剂的有SiO2、SiCl4;作为还原剂的有Si.
5.要检验久置的FeSO4溶液是否含有Fe3+,最好采用的方法是( )
| A. | 滴加KSCN溶液 | B. | 先加硝酸根,再加硝酸酸化 | ||
| C. | 利用焰色反应 | D. | 先加盐酸酸化,再加氯化钡 |
2. 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
(1)钒触媒(V2O5)能加快SO2的氧化速率,V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1.
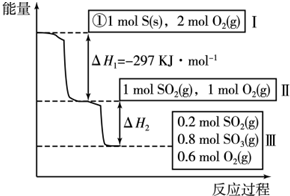
恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.
①写出能表示硫的燃烧热的热化学方程式为S(s)+O2(g)=SO2(g)△H=-297kJ•mol-1.
②在相同条件下,充入1molSO3和0.5mol的O2则达到平衡时SO3的转化率为20%,此时该反应吸收19.66kJ的能量.
(3)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1.
则:①α1+α2=1,a+b=196.6kJ.
②计算在该温度下此反应的平衡常数为80.
 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.(1)钒触媒(V2O5)能加快SO2的氧化速率,V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1.
恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.
①写出能表示硫的燃烧热的热化学方程式为S(s)+O2(g)=SO2(g)△H=-297kJ•mol-1.
②在相同条件下,充入1molSO3和0.5mol的O2则达到平衡时SO3的转化率为20%,此时该反应吸收19.66kJ的能量.
(3)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1.
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO2、2mol O2、 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| SO2或SO3的转化率 | α1 | α2 | α3 |
②计算在该温度下此反应的平衡常数为80.