题目内容
18.下列物质性质变化规律正确的是( )| A. | HI、HBr、HCl、HF的沸点依次降低 | B. | O、F、H的原子半径依次减小 | ||
| C. | 干冰、钠、冰的熔点依次降低 | D. | 金属Na、Mg、Al的硬度依次降低 |
分析 A.HF分子间存在氢键,在HX中其沸点最高;
B.电子层越多,原子半径越大,电子层相同时,核电荷数越大原子半径越小;
C.干冰为二氧化碳,三者中Na的熔点最高;
D.金属键键能越大,金属硬度越大,从影响金属键强弱的角度比较.
解答 解:A.由于氟化氢分子之间存在氢键,导致HF的沸点较高,正确的沸点大小为:HF>HI>HBr>HCl,故A错误;
B.O、F、H中,H只含有1个电子层,其原子半径最小,O、F含有2个电子层,核电荷数O<F,则原子半径O>F,所以O、F、H的原子半径依次减小,故B正确;
C.Na为金属,常温下为固体,其熔点最高,故C错误;
D.Na、Mg、Al原子半径逐渐减小,离子带电荷数目逐渐增大,金属键键能逐渐增强,则金属硬度逐渐增大,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的应用,为高频考点,侧重于学生的分析能力和基本概念、基本理论的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
15.下列指定反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 向FeI2溶液中加入少量氯水:2 Fe2++Cl2═2Fe3++2Cl-(已知:2Fe3++2I-═2 Fe2++I2) | |
| C. | 将过量铁粉投入稀硝酸中:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 将SO2通入Na2O2粉末中的主要反应为:2Na2O2+2SO2═2 Na2SO3+O2 |
13.下列元素中,原子M层电子数与K层数相同的有( )
| A. | F | B. | Mg | C. | Al | D. | Si |
10.苯甲酸钠(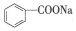 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
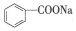 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) |
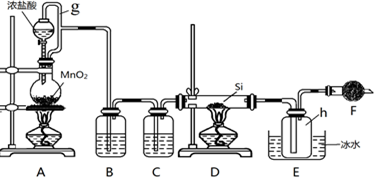
7.马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图:
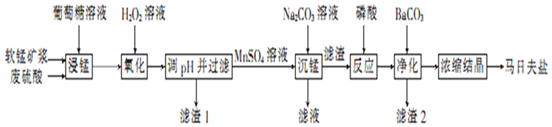
(1)软锰矿要先制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为12:1.
(2)用H2O2溶液“氧化”时发生反应的列子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3(填化学式).
(4)加入磷酸后发生反应的化学方程式为MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O.
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐2.5935t.

(1)软锰矿要先制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为12:1.
(2)用H2O2溶液“氧化”时发生反应的列子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3(填化学式).
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐2.5935t.