题目内容
2.下列关于Na2O与Na2O2的说法正确的是( )| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
分析 A.Na20是由钠离子和氧离子构成的离子化合物,Na202是由钠离子和过氧根离子构成的离子化合物;
B.过氧化钠与二氧化碳反应生成碳酸钠和氧气;
C.强氧化剂是物质的组成元素化合价降低的性质,根据元素化合价来判断;
D.过氧化钠与盐酸发生歧化反应,过氧化钠既做氧化剂又做还原剂.
解答 解:A.氧化钠中阴阳离子个数比为:2:1;过氧化钠中阴阳离子个数之比为:2:1,故A正确;
B.过氧化钠与二氧化碳反应生成碳酸钠和氧气,不属于化合反应,故B错误;
C.Na2O中氧元素的化合价是-2价,Na2O2中氧元素的化合价是-1价,Na2O2具有氧化性,故C错误;
D.过氧化钠与盐酸发生歧化反应,过氧化钠既做氧化剂又做还原剂,1molNa2O2与足量盐酸反应,转移电子的物质的量为1mol,故D错误;
故选:A.
点评 本题主要考查了物质的性质,掌握Na20与Na202的结构是解答本题的关键,题目难度不大,注意过氧化钠中阴离子为过氧根离子.

练习册系列答案
相关题目
12.下列叙述中,正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯化铝溶液中加入过量氨水反应实质是Al3++4NH3•H2O═AlO2-+4NHO${\;}_{4}^{+}$ |
10.一定条件下合成乙烯6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$ CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )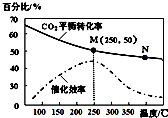

| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
17.短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍.下列说法不正确的是( )
| A. | 元素Z、W的简单离子的电子层结构相同 | |
| B. | 元素Y的简单气态氢化物的热稳定性比Z的弱 | |
| C. | W、Z两种元素形成的化合物中肯定不含共价键 | |
| D. | 由X、Y、Z三种元素形成化合物,其水溶液可能显碱性 |
7.下列各项叙述中正确的是( )
| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
14.工业上用反应 3Cl2+2NH3=N2+6HCl 检查氯气管道是否漏气,下列说法正确的是( )
| A. | 该反应属于复分解反应 | B. | 该反应中Cl2是还原剂 | ||
| C. | 该反应中NH3发生还原反应 | D. | 该反应生成1molN2有6mol电子转移 |
11.图为一种天然产物,具有一定除草功效.下列有关该化合物的说法正确的是 ( )
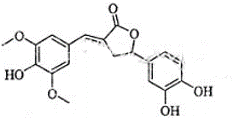

| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既能与FeC13发生显色反应,也能和NaHCO3反应放出CO2 | |
| D. | 既可以发生取代反应,又能够发生加成反应. |