题目内容
已知下列热化学方程式:①Zn(s)+
O2(g)═ZnO(s);△H1;②Hg(l)+
O2(g)═HgO(s);△H2.则反应Zn(s)+HgO(s)═Hg(l)+ZnO(s);△H3,△H3为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、△H1-△H2 |
| B、△H2-△H1 |
| C、△H1+△H2 |
| D、-(△H1+△H2) |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答:
解:已知:①Zn(s)+
O2(g)=ZnO(s)△H1
②Hg(l)+
O2(g)=HgO(s)△H2
根据盖斯定律,①-②得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=△H1-△H2,
故选A.
| 1 |
| 2 |
②Hg(l)+
| 1 |
| 2 |
根据盖斯定律,①-②得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=△H1-△H2,
故选A.
点评:本题考查盖斯定律、反应热的计算等,难度中等,注意盖斯定律的理解与运用.

练习册系列答案
相关题目
用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1一4.4).下列判断正确的是( )
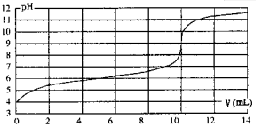

| A、HA的浓度为1×10-4mol?L-1 |
| B、实验时可选甲基橙作指示剂 |
| C、V=10mL,酸碱恰好中和 |
| D、pH=7时,溶液中c(Na+)>c(A-) |
有关甲醛(H2C=O)分子的说法正确的是( )
| A、C原子采取sp杂化 |
| B、甲醛分子为三角锥形结构 |
| C、C原子采取sp3杂化 |
| D、甲醛分子为平面三角形结构 |
量取25mL液体,应选用量筒的规格是( )
| A、10 mL |
| B、50 mL |
| C、20 mL |
| D、100 mL |
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题: 如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )
如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )