题目内容
用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1一4.4).下列判断正确的是( )
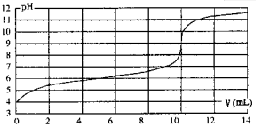

| A、HA的浓度为1×10-4mol?L-1 |
| B、实验时可选甲基橙作指示剂 |
| C、V=10mL,酸碱恰好中和 |
| D、pH=7时,溶液中c(Na+)>c(A-) |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:A、HA是弱酸,不完全电离,结合图象分析;
B、氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
C、由图象可知,当V=10mL,酸碱恰好中和;
D、根据电荷守恒来分析;
B、氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
C、由图象可知,当V=10mL,酸碱恰好中和;
D、根据电荷守恒来分析;
解答:
解:A、由图象分析可知,C(H+)=1×10-4mol?L-1,但HA是弱酸,不完全电离,所以HA的浓度为大于1×10-4mol?L-1,故A错误;
B、氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故B错误;
C、由图象可知,当V=10mL,酸碱恰好中和,故C正确;
D、pH=7时,C(H+)=C(OH-),根据电荷守恒可知,c(Na+)=c(A-),故D错误;
故选C.
B、氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故B错误;
C、由图象可知,当V=10mL,酸碱恰好中和,故C正确;
D、pH=7时,C(H+)=C(OH-),根据电荷守恒可知,c(Na+)=c(A-),故D错误;
故选C.
点评:本题考查酸碱混合的定性判断和计算,题目难度中等,本题注意把握弱电解质的电离特点,易错点为C,注意酸碱中和滴定的实验原理.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
操作1:将1L 1.00mol?L-1的Na2CO3溶液逐滴加入到1L 1.25mol?L-1的盐酸中;
操作2:将1L 1.25mol?L-1的盐酸逐滴加入1L 1.00mol?L-1 的Na2CO3溶液中,
两次操作产生的气体体积之比(同温同压下)是( )
操作2:将1L 1.25mol?L-1的盐酸逐滴加入1L 1.00mol?L-1 的Na2CO3溶液中,
两次操作产生的气体体积之比(同温同压下)是( )
| A、5:2 | B、2:5 |
| C、1:1 | D、2:1 |
已知下列热化学方程式:①Zn(s)+
O2(g)═ZnO(s);△H1;②Hg(l)+
O2(g)═HgO(s);△H2.则反应Zn(s)+HgO(s)═Hg(l)+ZnO(s);△H3,△H3为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、△H1-△H2 |
| B、△H2-△H1 |
| C、△H1+△H2 |
| D、-(△H1+△H2) |
对于某些离子的检验及结论一定正确的是( )
| A、加稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| C、加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| D、加入盐酸没有看到沉淀和气体,说明一定没有发生反应 |
下列有关除杂质(括号中为杂质)的操作中,肯定错误的是( )
| A、乙烷(乙烯):通过盛有足量溴水的洗气瓶 |
| B、溴乙烷(乙醇):多次加水振荡,分液,弃水层 |
| C、苯(甲苯):加酸性高锰酸钾溶液,振荡,分液除去 |
| D、溴苯(溴):加稀氢氧化钠溶液充分振荡洗涤后分液 |