题目内容
11.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |
分析 在2、3周期中,第IIA中和第IIIA族相邻;在4、5、6、7周期中第IIA族和第IIIB族相邻,据此分析解答.
解答 解:在2、3周期中,第IIA中和第IIIA族相邻;在4、5、6、7周期中第IIA族和第IIIB族相邻,如果n为第ⅡA族中某元素的原子序数,在2、3周期中原子序数为(n+1)的元素位于第IIIA族,在4、5、6、7周期中原子序数为(n+1)的元素位于第IIIB族,故选D.
点评 本题考查元素周期表结构及其应用,为高频考点,明确元素周期表结构、原子序数之间的关系是解本题关键,注意从第四周期开始出现副族和第VIII族元素,题目难度不大.

练习册系列答案
相关题目
1.北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是溶液由蓝色恰好变为无色.
②b中反应所产生的I2的物质的量是1.0×10-5 mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是溶液由蓝色恰好变为无色.
②b中反应所产生的I2的物质的量是1.0×10-5 mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
2.以下物质既能使酸性KMnO4溶液褪色,又能使溴水因发生化学反应而褪色的是( )
①甲醛②苯③聚乙烯④聚乙炔⑤2-丁炔⑥环己烷⑦邻二甲苯⑧苯乙烯.
①甲醛②苯③聚乙烯④聚乙炔⑤2-丁炔⑥环己烷⑦邻二甲苯⑧苯乙烯.
| A. | ①④⑤⑧ | B. | ④⑤⑦⑧ | C. | ①③④⑤ | D. | ③④⑤⑦⑧ |
19.下列结论不正确的是( )
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:Cl-<Br-<I- | ||
| C. | 酸性:H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
6.下列说法错误的是( )
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加入稀释的过程中c(OH-)不断增大 | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8mol•L-1,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
16.有关下列微粒的化学用语正确的是( )
| A. | CS2的电子式为: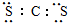 | B. | Ca2+的离子结构示意图为: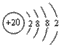 | ||
| C. | HClO的结构式为:H-O-Cl | D. | 氯化铵的电子式为: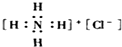 |
3.下列化学用语正确的是( )
①乙烯的结构简式:CH2CH2
②明矾的化学式:KAlSO4•12H2O
③CSO的电子式:
④铬原于价电子层排布图
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+
⑧淀粉的分子式:(C6H10O5)n
⑨对硝基苯酚的结构简式:
⑩Cl-的结构示意图
①乙烯的结构简式:CH2CH2
②明矾的化学式:KAlSO4•12H2O
③CSO的电子式:

④铬原于价电子层排布图

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+
⑧淀粉的分子式:(C6H10O5)n
⑨对硝基苯酚的结构简式:

⑩Cl-的结构示意图

| A. | ③④⑤⑧ | B. | ③⑤⑧ | C. | ③⑤⑧⑨ | D. | ①③⑤⑥⑦⑧⑩ |
20.运用元素周期表的变化规律,推断下列说法不正确的是( )
| A. | 铍是一种轻金属,它的氧化物对应水化物可能是两性 | |
| B. | 砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸锶难溶于水和稀HNO3,其氢氧化物为强酸 | |
| D. | 硒化氢是无色气体,没有H2S稳定 |

 +n HOCH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2OH$→_{△}^{浓硫酸}$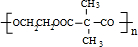 +2n H2O
+2n H2O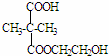 ;
;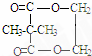 ;
;