题目内容
17.为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论.乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.
已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
(1)稀硝酸和Cu反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:将铜片放入氯化铁溶液中.
分析 (1)稀硝酸和Cu反应生成硝酸铜、NO和水;
(2)铁离子水解呈酸性,如验证乙同学的看法是否正确,可测定0.5mol/L Fe(NO3)3溶液的pH,然后在硝酸钠溶液中滴加盐酸,与硝酸铁溶液PH相同、硝酸根离子浓度相同,加入铜观察是否反应;
(3)甲同学的实验方案中溶液逐渐变成蓝绿色,pH略有上升,说明铁离子氧化铜,注意比较离子水解的程度;乙同学的实验方案无明显现象,pH没有明显变化,说明不反应;
(4)如证明铁离子氧化铜,可排除硝酸根离子的影响,应用其它可溶性铁盐.
解答 解:(1)稀硝酸和Cu反应生成硝酸铜、NO和水,反应的方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)铁离子水解呈酸性,如验证乙同学的看法是否正确,可测定0.5mol/L Fe(NO3)3溶液的pH,然后在硝酸钠溶液中滴加盐酸,与硝酸铁溶液PH相同、硝酸根离子浓度相同,做法是测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应,
故答案为:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应;
(3)①甲同学的实验方案中溶液逐渐变成蓝绿色,pH略有上升,说明铁离子氧化铜,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
②因Fe3+ 变为Cu2+和Fe2+,水解能力下降,导致实验过程中溶液pH略有上升,
故答案为:Fe3+ 变为Cu2+和Fe2+,水解能力下降;
③乙同学的实验方案无明显现象,pH没有明显变化,说明不反应,
故答案为:在此酸性条件下NO3-不能氧化Cu;
(4)如证明铁离子氧化铜,可排除硝酸根离子的影响,应用其它可溶性铁盐,如0.5mol/L氯化铁溶液,
故答案为:将铜片放入0.5mol/L氯化铁溶液中.
点评 本题以硝酸铁的性质探究为载体考查物质的性质实验,为高考常见题型,侧重学生的分析能力和实验能力的考查,注意把握实验的严密性和实验原理的评价,题目难度中等.

| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
| A. | lNA | B. | 2NA | C. | 3NA | D. | 0.5NA |
| A. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA | |
| B. | 1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA | |
| C. | 7.2g CaO2中的阴离子含有的电子数为1.0NA | |
| D. | 标准状况下,22.4L盐酸含有2NA个离子 |
(1)制备硅半导体材料必须先得到高纯硅.四氯甲硅烷(SiCl4)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiCl4制备高纯硅的化学反应方程式SiCl2+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
②整个制备过程必须严格控制无水无氧.SiCl4遇水剧烈反应生成H2SiO3和另一种物质,写出配平的化学反应方程式SiCl4+3H2O═H2SiO3↓+4HCl↑.
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需依次加入的试剂顺序是db.(填写字母代号)
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(2)下列有头硅材料的说法不正确的是C(填字母).
A.碳化硅化学性质稳定、硬度大,可用于砂纸、砂轮的磨料
B.含4%硅的硅钢具有很高的导磁性,可用作变压器铁芯
C.硅橡胶保持良好的弹性,耐高温但不耐低温.
D.人造分子筛是一种硅酸盐,用作吸附剂和催化剂.
| 编号 | 实验 | 现象 |
| ① | 放入蒸馏水 | 木条燃烧 |
| ② | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
| A. | 方便添加木柴 | B. | 升高木柴的温度 | ||
| C. | 降低木柴的着火点 | D. | 使木柴与空气充分接触 |
| A. | H2O2的电子: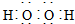 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: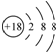 | |
| D. | FeSO4的电离方程式:FeSO4═Fe3++SO42- |

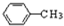 .
. .
.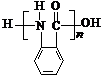 的单体.
的单体.
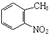 ,试剂a为酸性高锰酸钾溶液.
,试剂a为酸性高锰酸钾溶液.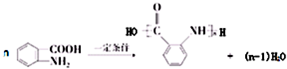 .
.