题目内容
7.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
分析 A.蒸馏水的pH=6,则c(H+)=c(OH-)=1×10-6 mol•L-1,KW=1×10-12>1×10-14,结合水的电离过程吸热分析;
B.氢离子抑制了水的电离,溶液中氢氧根离子是水电离的;
C.硫酸氢钠电离出的氢离子抑制了水的电离;
D.根据硫酸氢钠溶液中的电荷守恒、物料守恒分析.
解答 解:A.蒸馏水的pH=6,说明c(H+)=c(OH-)=1×10-6 mol•L-1,KW=1×10-12>1×10-14,说明温度高于25℃,故A正确;
B.水电离出来的氢离子的浓度等于溶液中氢氧根离子的浓度,c(H+)水=c(OH-)=$\frac{KW}{c(Η+)}$=$\frac{1×10-12}{0.01}$mol/L=1×10-10 mol•L-1,故B错误;
C.NaHSO4晶体溶于蒸馏水中能电离出氢离子,相当于一元强酸,抑制了水的电离,故C正确;
D.根据电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(SO42-),由于c(Na+)=c(SO42-),则c(H+)=c(OH-)+c(SO42-),故D正确;
故选B.
点评 本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,明确水的电离及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,是有利于提高学生的灵活应用能力.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
9.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1 Na2S溶液中一定有:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 向NH4Cl溶液中加入适量氨水,得到的碱性混合溶液中一定有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 加热Na2S溶液,溶液c(OH-)肯定增大,c(H+)肯定减小 | |
| D. | 加水稀释0.1mol•L-1醋酸溶液,电离平衡向右移动,c(H+)一定减小 |
12.在某学生的化学实验报告中有如下记录其中实验数据合理的( )
| A. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| B. | 用托盘天平称取11.7 g CuO粉末 | |
| C. | 用广泛pH试纸测得溶液的pH为3.5 | |
| D. | 温度计上显示的室温读数为25.68 oC |
17.为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论.
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.
已知:
请回答:
(1)稀硝酸和Cu反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
①根据实验现象写出发生反应的离子方程式:Cu+2Fe3+═Cu2++2Fe2+.
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:将铜片放入氯化铁溶液中.
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.
已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
(1)稀硝酸和Cu反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:将铜片放入氯化铁溶液中.

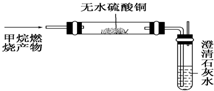 (1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.
(1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.