题目内容
8.芳香烃X,相对分子质量为92.以X为初始原料合成E,路线如下(部分产物和反应条件已略去).
回答下列问题:
(1)有机物X的结构简式为
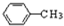 .
.(2)C→D转化中①的化学方程式为
 .
.(3)下列关于B的说法正确的是ac.(填字母)
a.核磁共振氢谱有5个峰 b.能发生消去反应和还原反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(4)E有多种同分异构体,同时符合下列条件的同分异构体共有14种.
①遇NaHCO3溶液有气体放出②芳香族化合物
(5)有机物X可通过三步合成W,W是高分子化合物
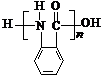 的单体.
的单体.已知:
I.苯环上的甲基可以被酸性KMnO4氧化成羧基;
II.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化.

①F的结构简式为
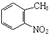 ,试剂a为酸性高锰酸钾溶液.
,试剂a为酸性高锰酸钾溶液.②在一定条件下W聚合成高分子化合物的化学方程式为
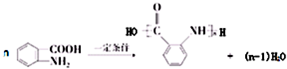 .
.
分析 相对分子质量为92的某芳香烃X,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 ,苯甲酸与乙醇发生酯化反应生成E为
,苯甲酸与乙醇发生酯化反应生成E为 ;
;
(5)由高分子化合物的结构简式,逆推可知W为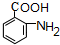 ,
, 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,G与Fe/HCl反应生成W.
,G与Fe/HCl反应生成W.
解答 解:相对分子质量为92的某芳香烃X,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 ,苯甲酸与乙醇发生酯化反应生成E为
,苯甲酸与乙醇发生酯化反应生成E为 ;
;
(1)通过以上分析知,A结构简式为 ,故答案为:
,故答案为: ;
;
(2)C→D转化中是 与银氨溶液发生氧化反应生成
与银氨溶液发生氧化反应生成 ,反应方程式为:
,反应方程式为:
故答案为: ;
;
(3)B为 ,
,
a.B中含有5种氢原子,则核磁共振氢谱有5个峰,故正确;
b.含有苯环,能和氢气发生还原反应,因为连接醇羟基碳原子相邻碳原子上不含氢原子,则不能发生消去反应,故错误;
c.含有醇羟基,则能与钠反应放出氢气,故正确;
d.不含酚羟基或羧基,所以没有酸性,不能和NaOH溶液反应,故错误;
故选ac;
(4)E( )的同分异构体同时符合下列条件:
)的同分异构体同时符合下列条件:
①遇NaHCO3溶液有气体放出,说明含有羧基,②芳香族化合物,说明含有苯环,含有一个取代基为-CH2CH2COOH或者-CH(CH3)COOH,含有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-COOH,各有邻、间、对3种,含有3个取代基为2个-CH3、-COOH,2个-CH3处于邻位,-COOH有2种位置,2个-CH3处于间位,-COOH有3种位置,2个-CH3处于对位,-COOH有1种位置,共有14种,
故答案为:14;
(5)由高分子化合物的结构简式,逆推可知W为 ,
, 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,G与Fe/HCl反应生成W,
,G与Fe/HCl反应生成W,
①通过以上分析知,F结构简式为 ,a为酸性高锰酸钾溶液,故答案为:
,a为酸性高锰酸钾溶液,故答案为: ;酸性KMnO4溶液;
;酸性KMnO4溶液;
②W中含有羧基和氨基,在一定条件下能发生缩聚反应生成高分子化合物,反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,涉及物质推断、方程式的书写、同分异构体种类判断等知识点,明确物质之间的转化及官能团与性质关系是解本题关键,难点是限制型同分异构体种类判断,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 保持温度和体积不变,加入少许N2O4,再达到平衡时,颜色变深 | |
| B. | 保持温度和体积不变,加入少许NO2,将使正反应速率减小 | |
| C. | 保持温度不变,增大压强时,将使正反应速率增大,逆反应速率减小 | |
| D. | 保持体积不变,升高温度,再达平衡时颜色变浅 |
| A. | 0.21 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.
已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
(1)稀硝酸和Cu反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:将铜片放入氯化铁溶液中.
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐溶液一定能与碱反应 |
 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳的化合物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳的化合物.