题目内容
12.NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA | |
| B. | 1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA | |
| C. | 7.2g CaO2中的阴离子含有的电子数为1.0NA | |
| D. | 标准状况下,22.4L盐酸含有2NA个离子 |
分析 A、求出二氧化氮的物质的量,然后根据3mol二氧化氮和水反应转移2mol电子来分析;
B、1mol铁在1mol氯气中燃烧时,铁过量,根据氯气反应后变为-1价来分析;
C、求出过氧化钙的物质的量,然后根据1mol过氧化钙中含1mol过氧根,而1mol过氧根中含18mol电子来分析;
D、标况下盐酸为液态.
解答 解:A、标况下6.72L二氧化氮的物质的量为0.3mol,而3mol二氧化氮和水反应转移2mol电子,故0.3mol二氧化氮转移0.2NA个电子,故A正确;
B、1mol铁在1mol氯气中燃烧时,铁过量,而氯气反应后变为-1价,故1mol氯气反应转移2NA个电子,故B错误;
C、7.2g过氧化钙的物质的量为0.1mol,而1mol过氧化钙中含1mol过氧根,而1mol过氧根中含18mol电子,故含1.8NA个电子,故C错误;
D、标况下盐酸为液态,故不能根据气体摩尔体积来计算其物质的量和含有的离子个数,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL 4mol•L-1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
| A. | 0.21 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
7.下列说法错误的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有总能量的相对大小 | |
| D. | 吸热反应在一定的条件下也能发生 |
17.为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论.
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.
已知:
请回答:
(1)稀硝酸和Cu反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
①根据实验现象写出发生反应的离子方程式:Cu+2Fe3+═Cu2++2Fe2+.
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:将铜片放入氯化铁溶液中.
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.
已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
(1)稀硝酸和Cu反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:将铜片放入氯化铁溶液中.
1.下列物质放入水中,不能形成溶液的是( )
| A. | 蔗糖 | B. | 氯化钠 | C. | 硝酸铵 | D. | 植物油 |
2.下列说法正确的是( )
| A. | 20Ne和22Ne互为同位素 | |
| B. | 液氯和氯水是同一种物质 | |
| C. | 金刚石、石墨和富勒烯互为同分异构体 | |
| D. | 碘单质和碘蒸气互为同素异形体 |
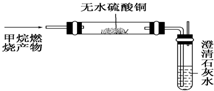 (1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.
(1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染. 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳的化合物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳的化合物.