题目内容
下列溶液中的氯离子浓度与50mL0.1mol/L氯化铝溶液中的氯离子浓度相等的是( )
| A、150mL 0.1mol/L NaCl |
| B、75mL 0.2mol/L NH4Cl |
| C、100mL 0.3mol/L KCl |
| D、150mL 0.1mol/L FeCl3 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据化学式可知0.1mol?L-1的AlCl3溶液中氯离子浓度为0.3mol/L,结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关.
解答:
解:50mL 0.1mol?L-1AlCl3溶液中,氯离子的物质的量浓度为:0.1mol?L-1×3=0.3mol?L-1;
A、150 mL 0.1 mol?L-1NaCl溶液中,Cl-浓度为0.1mol?L-1×1=0.1mol?L-1,故A错误;
B、75 mL 0.2mol?L-1氯化铵溶液中,Cl-浓度为0.2mol?L-1×1=0.2mol?L-1,故B错误;
C、100 mL 0.3 mol?L-1KCl溶液中,Cl-浓度为0.3mol?L-1×1=0.3mol?L-1,故C正确;
D、150mL 0.1mol?L-1FeCl3溶液中,Cl-浓度为0.1mol?L-1×3=0.3mol?L-1,故正确;
故选CD.
A、150 mL 0.1 mol?L-1NaCl溶液中,Cl-浓度为0.1mol?L-1×1=0.1mol?L-1,故A错误;
B、75 mL 0.2mol?L-1氯化铵溶液中,Cl-浓度为0.2mol?L-1×1=0.2mol?L-1,故B错误;
C、100 mL 0.3 mol?L-1KCl溶液中,Cl-浓度为0.3mol?L-1×1=0.3mol?L-1,故C正确;
D、150mL 0.1mol?L-1FeCl3溶液中,Cl-浓度为0.1mol?L-1×3=0.3mol?L-1,故正确;
故选CD.
点评:本题考查了物质的量浓度的计算,难度较小,明确物质的构成是解答本题的关键,并注意离子的浓度与溶液的浓度的关系来解答即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
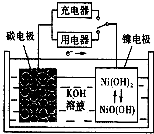 用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A、放电时,负极的电极反应为:H2-2e-+2OH-=2H2O |
| B、充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C、放电时,OH-移向镍电极 |
| D、充电时,将电池的碳电极与外电源的正极相连 |
下列化学用语正确的是( )
| A、乙烯的结构简式 C2H4 |
B、苯分子的结构式 |
C、氯离子的结构示意图  |
D、水的电子式 |
下列关于有机物的说法正确的是( )
| A、油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收 |
| B、甲酸甲酯(HCOOCH3)和乙酸是同分异构体 |
| C、石油催化裂化的主要目的是提高芳香烃的产量 |
D、聚丙烯的结构简式为 |
下列叙述正确的是( )
| A、常温下,78 g Na2O2中含有的阴离子数是2NA |
| B、标准状况下,22.4LSO3的物质的量为1mol |
| C、常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA |
| D、铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2 NA |
下列有关原电池的叙述中,错误的是( )
| A、原电池是将化学能转化为电能的装置 |
| B、用导线连接的两种不同金属同时插入液体中,能形成原电池 |
| C、在原电池中,电子流出的一极是负极,发生氧化反应 |
| D、在原电池放电时,电解质溶液中的阳离子向正极移动 |
下列实验与物质粒子大小无直接关系的是( )
A、 过滤 |
B、 渗析 |
C、 萃取 |
D、 丁达尔效应 |
下列说法正确的是( )
| A、蛋白质的变性是一个可逆过程 |
| B、蔗糖和麦芽糖的水解产物完全相同 |
| C、误服重金属盐,立即服用牛奶或豆浆可解毒 |
| D、糖类、脂类、蛋白质都属于天然高分子化合物 |
下列说法正确的是( )
| A、复分解反应中有的是氧化还原反应,有的不是氧化还原反应 |
| B、置换反应有可能是非氧化还原反应 |
| C、化合反应一定是氧化还原反应 |
| D、分解反应不一定是氧化还原反应 |