题目内容
3.下列说法正确的是( )| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第二周期元素的最高化合价为+1→+7 |
分析 A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强;
B.第ⅥA族元素中,非金属性越强,氢化物越稳定,对应单质的氧化性越强;
C.同周期,从左向右非金属性增强,对应最高价氧化物的水化物酸性增强;
D.第二周期元素O、F没有正价.
解答 解:A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,若不在同周期,可能第ⅡA族元素的金属性强,如金属性Ca>Na,故A错误;
B.第ⅥA族元素中,非金属性越强,氢化物越稳定,对应单质的氧化性越强,则第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强,故B正确;
C.同周期,从左向右非金属性增强,对应最高价氧化物的水化物酸性增强,同周期非金属氧化物对应水化物的酸性无规律,故C错误;
D.第二周期元素O、F没有正价,则第二周期元素的最高化合价为+1→+5,故D错误;
故选B.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列不是用来确定有机物结构或官能团的是( )
| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 质谱 | D. | 银镜反应 |
8.下列离子方程式书写正确的是( )
| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
15.下列反应不属于加成反应的是( )
| A. | CH≡CH+2Br2→CHBr2-CHBr2 | B. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | ||
| C. |  +HCN$\stackrel{催化剂}{→}$ +HCN$\stackrel{催化剂}{→}$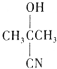 | D. | CH3COOH+NH3$\stackrel{△}{→}$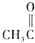 -NH2+H20 -NH2+H20 |
13.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 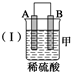 | 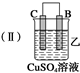 | 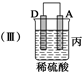 |
| 现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
 .
.