题目内容
16.将两个铂电极插入KOH溶液中,向两极分别通入H2和O2即可构成氢氧燃料电池.对其有关说法正确的是( )| A. | 通入氧气的一极为正极,发生氧化反应 | |
| B. | 该电池负极的电极反应为2H2-4e-=4H+ | |
| C. | 该电池工作一段时间,电解质溶液浓度保持不变 | |
| D. | 该电池在工作时,溶液中的阴离子向负极移动 |
分析 碱性燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,其电极反应是:2H2-4e-+4OH-=4H2O,通入氧气的一极为电池的正极,发生还原反应,其电极反应是:O2+2H2O+4e-═4OH-,溶液中阴离子流向负极,阳离子流向正极,以此解答该题.
解答 解:A.燃料原电池中,通入氧化剂的电极为正极,氧气得电子发生还原反应,故A错误;
B.通入氢气的一极为电池的负极,发生氧化反应,其电极反应是:2H2-4e-+4OH-=4H2O,故B错误;
C.电池总反应为氢气与氧气反应生成水,溶液的体积增大,电解质溶液浓度减小,故C错误;
D.放电时,溶液中阴离子流向负极,阳离子流向正极,故D正确.
故选D.
点评 本题考查碱性燃料电池的工作原理,题目难度不大,注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意归纳电子、电流、离子的流向.

练习册系列答案
相关题目
4.如图是某化学反应过程中能量变化的曲线图.下列有关叙述正确的是( )


| A. | 该反应为吸热反应 | |
| B. | 该图可以表示Ba(OH)2•8H2O与NH4Cl的反应 | |
| C. | 化学反应中的能量变化只表现为热量的变化 | |
| D. | 化学反应中有旧键断裂就一定有新键形成 |
11.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( )
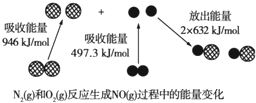

| A. | 通常情况下,NO比N2稳定 | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接反应生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量 | |
| D. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ |
8.于谦的《石灰吟》,赞颂了石灰石(碳酸钙)“粉骨碎身浑不怕,要留清白在人间”的品格.碳酸钙属于( )
| A. | 单质 | B. | 氧化物 | C. | 酸 | D. | 盐 |
6.CH2=CH-CH3加聚反应的产物是( )
| A. |  | B. |  | C. |  | D. | CH2=CH2 |
 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: $→_{AlCl_{3}}^{CH_{3}CH=CH_{2}}$
$→_{AlCl_{3}}^{CH_{3}CH=CH_{2}}$ $→_{反应①}^{氯代反应}$[A]$\stackrel{反应②}{→}$
$→_{反应①}^{氯代反应}$[A]$\stackrel{反应②}{→}$ $\stackrel{反应③}{→}$
$\stackrel{反应③}{→}$ $\stackrel{反应④}{→}$[D](Mr=136)$\stackrel{反应⑤}{→}$
$\stackrel{反应④}{→}$[D](Mr=136)$\stackrel{反应⑤}{→}$
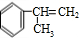 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$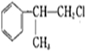 、
、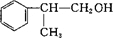 +NaCl.
+NaCl. .
.